查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





免疫检查点抑制剂的发现和应用为肿瘤治疗带来了新的希望和曙光,而其应用于新辅助治疗仍然在不断地探索中。今天,小编来和你说说免疫检查点抑制剂用于新辅助治疗的利与弊。
辅助治疗用于手术后,而新辅助治疗用在手术前。新辅助治疗可以在手术切除后,存在更多的肿瘤特异性活化的免疫细胞,产生持久的免疫。
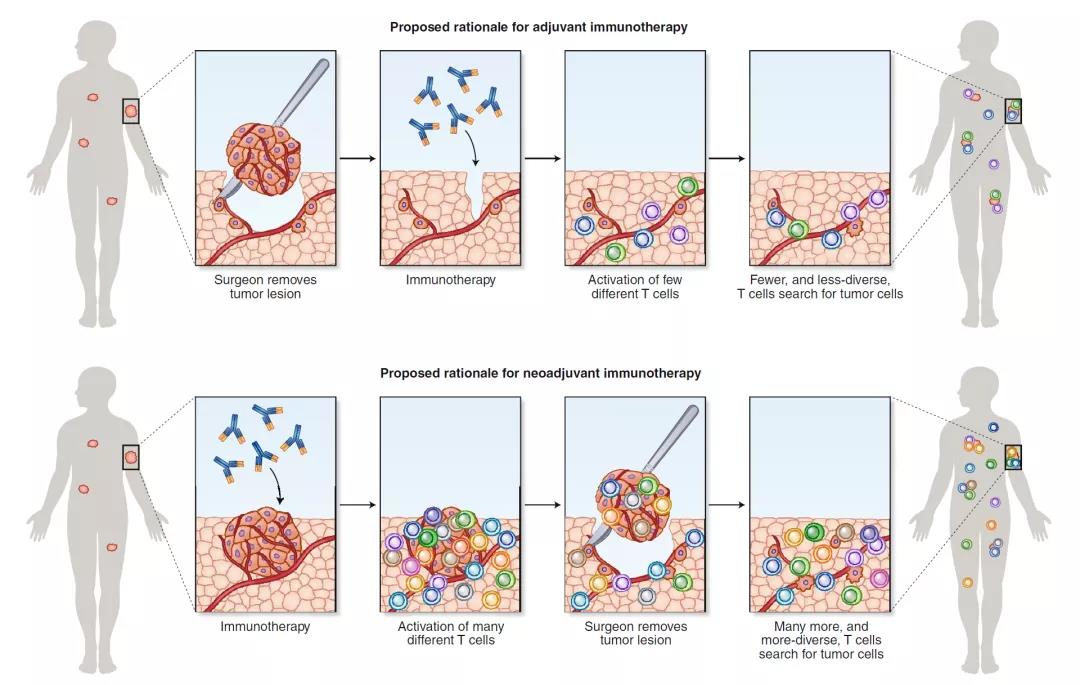
辅助治疗和新辅助治疗的区别
新辅助免疫治疗策略的基础是诱导T细胞扩增,在T细胞功能较少受损的癌症早期阶段有更大效用,通过手术标本的常规活检,评估治疗效果,以及手术前免疫治疗减少肿瘤大小,可能改善手术结果。
OpACIN研究中,20位macroscopic stage Ⅲ 黑色素瘤患者,各10例接受新辅助和辅助治疗,显示新辅助可以诱导更强的肿瘤局部聚居T细胞克隆扩增。
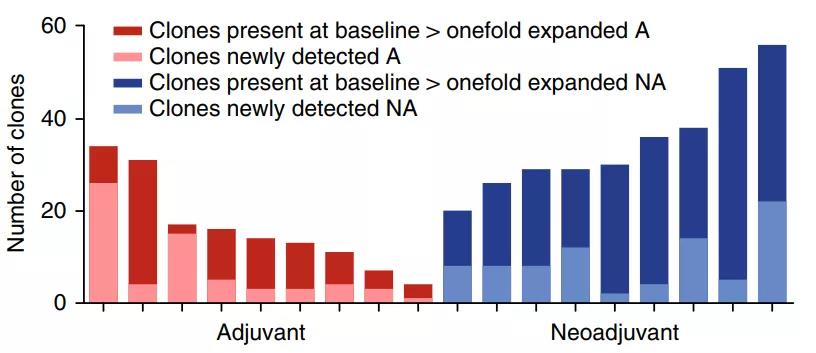
文献1
类似的结果也在非小细胞肺癌(NSCLC)发现。
新辅助治疗持续时间是一个问题。国际新辅助黑色素瘤联合会(INMC)经验性选择6~8周,然后分析治疗效果,不会太延迟手术时间。
第一,与辅助治疗相比,患者对检查点阻断的反应,可在手术时由病理活检进行评估,如果需要额外的全身辅助治疗,可以提前做出方案。
第二,可以减少手术前的肿瘤负荷,这可能提高手术可切除性,从而降低发病率。
新辅助治疗无反应的患者,等到手术切除时,已经恶化,预后差。但是,可能这个恶化过程和新辅助并无关联。
新辅助治疗的免疫相关毒性,可能延缓手术时间。
标准的新辅助治疗之后,收获大量的样本,进行应答机制和原发性耐药机制的研究,以及相应的生物标志物研究,而这些研究为设计新的治疗策略提供了基础。
新辅助药物治疗通过病理检查确定疗效。 一项黑色素瘤新辅助治疗研究(OpACIN-neo研究)通过病理评估6周新辅助治疗后的治疗效应,优于放射学评估,可用作无复发进展(RFS)期和总生存(OS)期的替代标记。
肿瘤的不同组织pattern已被识别、分类,并与黑色素瘤新辅助疗法的良好病理反应相关;初步数据表明,检查点阻断后,肿瘤床密集发炎,显示细胞死亡、肿瘤消退和组织坏死等。
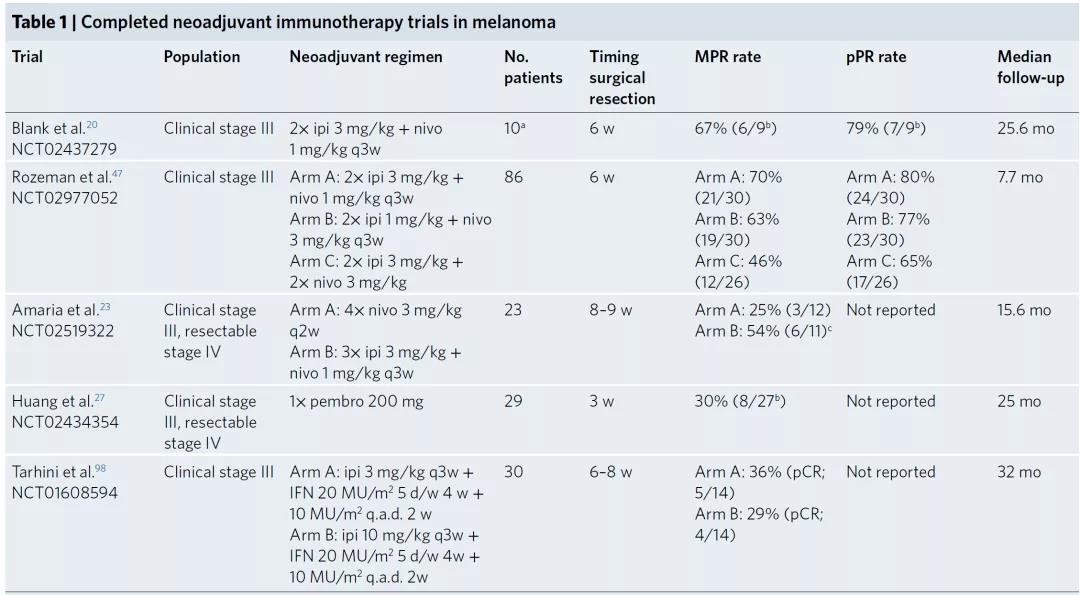
和化疗或者其他靶向治疗新辅助疗法相比,在免疫检查点阻断新辅助治疗中,病理缓解是比无进展生存(PFS)期更好的标志物。这种差异是由于检查点抑制和靶向治疗介导肿瘤杀死机制不同。对于新辅助检查点抑制,尽管INMC正在努力提供证据,病理缓解尚未被监管机构接受为终点。
在NSCLC中PD-1阻断后的组织病理学特征是纤维化、新生血管、胆固醇结晶、大量肿瘤浸润淋巴细胞(TILs)和三级淋巴结构(TLSs)形成。黑色素瘤肿瘤的病理特征表现为肿瘤免疫浸润、浆细胞聚集、巨噬细胞浸润、增殖纤维化和新生血管形成。
人们认为,TLSs在支持局部和全身T细胞和B细胞抗肿瘤反应中起着至关重要的作用。淋巴样新生发生在非淋巴样器官,如肿瘤,局部慢性炎症,TLSs在肿瘤微环境中的存在与癌症患者的良好临床结果有关。
在肿瘤内,CD4+ T细胞集中在TLSs中,而CD8+ T细胞浸润所有区域。因此,新的治疗组合,可以诱导TLS形成在‘冷肿瘤’。
肿瘤微环境中肿瘤浸润CD8+ T细胞的存在也与几种恶性肿瘤的长期存活有关。
这种细胞缺乏,反映了T细胞启动效率低下(可能由于没有肿瘤抗原、缺乏抗原提呈细胞,抑制性检查点等)或T细胞对肿瘤缺乏趋化力量。
在预处理肿瘤标本中浸润边缘CD8+ T细胞密度的增加与转移性黑色素瘤对PD-1阻断的反应有关。在黑色素瘤抗PD-1治疗期间,在应答患者中的连续活检中,浸润边缘和肿瘤中心T细胞的平行增加,而在进展的患者中则没有。
比如在OpACIN trial中IFN-γ,T细胞炎症,Batf3 DCs和改善的临床结果相关。
表达CLEC9和XCR1的Batf3DCs具有携带肿瘤抗原、运输至引流淋巴结,并在此递呈抗原的特殊能力。 此外,在β-catenine表达的肿瘤中,激活的Batf3 DCs使T细胞迁移到肿瘤。Batf3DC相关基因的表达,如CLEC9,与生存呈正相关。
鉴于CLEC9 Batf3DCs作用的发现,对新辅助免疫治疗的up-front耐药可能更有可能是由于引流淋巴结内T细胞激活不足,而不是肿瘤本身T细胞归巢或效应功能的缺陷所致。这使得靶向介导全身免疫抑制的机制(例如PD-L1表达的外泌体)成为新辅助组合检查点阻断的一种有吸引力的新方法。
众所周知,在晚期或者恶性肿瘤患者,高TMB和免疫治疗疗效有一定的相关性,原因是TMB可能会产生大量的肿瘤新生抗原,而肿瘤新生抗原可以刺激机体产生针对肿瘤的特异性免疫反应。有报道,高IFN-γ和高TMB患者,在伊匹木单抗+纳武利尤单抗新辅助治疗中,有高应答。
免疫检查点联合或者免疫检查点联合化疗
闲谈 Immunology 平台发布
查看更多