查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





世界级肿瘤盛会ESMO已于2023年10月24日在西班牙马德里落下帷幕,大会涵盖了肿瘤领域众多前沿进展,除传统化疗、常见的靶向治疗、免疫治疗外,还有许多创新药物也在不断探索,在妇科肿瘤领域也取得了不错的研究结果,为耐药问题的解决、少见病理类型、复发/转移性疾病治疗突破等提供了新的机会。本期邀请到山东大学齐鲁医院青岛院区张培海教授针对2023 ESMO妇科肿瘤相关创新治疗研究进行梳理和解读。
张培海 教授
山东大学齐鲁医院青岛院区妇科主任
主任医师,教授,医学博士,硕士研究生导师
中国抗癌协会第一届妇科肿瘤整合康复专业委员会委员
中国抗衰老促进会生殖与生育分会副会长
中国医药教育协会妇科肿瘤医学教育委员会委员
山东省医学会妇科肿瘤分会副主任委员
山东省医学会妇科肿瘤多学科联合委员会第一届委员会委员
山东省抗癌协会妇科肿瘤分会宫颈癌学组副主任委员
山东省医师协会妇科腹腔镜医师分会副主任委员
山东省医师协会妇科宫腔镜医师分会副主任委员
山东省疼痛医学会卵巢癌多学科协作专业委员会副主任委员
山东省医学伦理分会妇科学工作委员会副主任委员
青岛市医学会副主任委员
青岛医学会妇科肿瘤专科委员会副主任委员
一、铂耐药及后线卵巢癌治疗探索
【745MO】Raludotatug deruxtecan(R-DXd;DS-6000)单药用于既往经治卵巢癌患者:首次人体Ⅰ期研究的亚组分析
R-DXd是一种靶向钙黏蛋白6(CDH6)的ADC。研究纳入了60例不适合标准治疗的晚期/转移性卵巢癌接受R-DXd(4.8-8.0 mg/kg)治疗,其中55例(91.7%)铂耐药,中位既往系统治疗线数为4(范围1-13)。确认的ORR为46%,DCR 98%,mDOR 11.2个月,mPFS 7.9个月。在未进行CDH6表达筛选的重度预处理PRROC中,R-DXd显示出可管理的安全性和有前景的初步疗效,为进一步临床研究提供了支持1。
图1. 靶病灶直径总和较基线的最佳变化
【753P】FAK抑制剂IN10018联合PLD治疗铂耐药卵巢癌:一项单臂、开放标签、Ⅰb期临床试验
FAK(粘着斑激酶)在卵巢癌高表达并与不良预后相关,IN10018是一种高效选择性口服FAK抑制剂。研究共入组61例PROC患者,中位随访14个月。ORR为46.3%,DCR 83.3%,mOS 20.9个月,mPFS 7.56个月。IN10018联合PLD在PROC患者中显示出可管理的安全性和延长的生存期,一项安慰剂对照、随机、双盲Ⅱ期试验正在进行中,以确认观察到的有效性和安全性2。
【754P】Ubamatamab(MUC16xCD3双特异性抗体)联合Cemiplimab治疗复发性卵巢癌的Ⅰ期剂量递增研究
临床前研究已证实Ubamatamab对MUC16表达OC细胞的剂量独立性抗肿瘤活性,抗PD-1抗体Cemiplimab可增强Ubamatamab活性。该研究Ubamatamab和Cemiplimab联合治疗队列共纳入35例重度预处理及高危患者,中位既往治疗线数5(范围1-10),总人群43%患者有内脏转移,观察到可接受的安全性和持久缓解。Ubamatamab ± Cemiplimab的随机Ⅱ期扩展研究正在进行3。
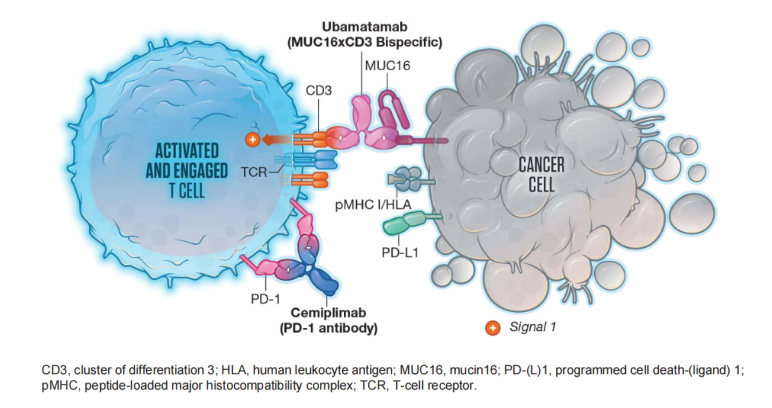
图2. Ubamatamab作用机制
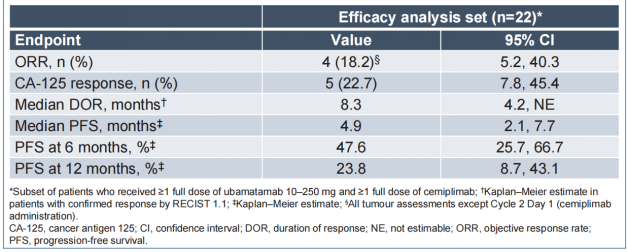
表1. Ubamatamab + Cemiplimab临床活性
【756P】靶向Claudin 6(CLDN6)的新型ADC TORL-1-23的首次人体Ⅰ期研究
CLDN6是细胞间紧密连接的跨膜蛋白,在多种癌症中高表达。研究纳入CLDN6+铂耐药卵巢癌/难治性NSCLC及其他晚期实体瘤,结果显示,TORL-1-23在0.2-2.4mg/kg剂量范围内耐受性良好;初始PK数据表明,与其他含MMAE的ADC相比,游离MMAE的暴露量降低;在低于MTD的剂量探索期间,在重度预处理卵巢癌患者中观察到有前景的抗肿瘤疗效,支持进一步评估4。
【818TiP】评估Luveltamab Tazevibulin vs 研究者选择的化疗用于FolRα表达PRROC疗效和安全性的开放标签、II/III期REFRaME-O1研究
FolRα在OC和EC等多种癌症中过表达,LuveltamabTazevibulin(Luveltamab或STRO-002)是一种新型靶向FolRα的ADC。在Ⅰ期剂量扩展研究STRO-002-GM1中,Luveltamab单药在PRROC中已显示初步疗效(32例FolRα高表达EOC中,ORR为37.5%,中位DOR 5.5个月,中位PFS 6.1个月)。REFRaME-O1(STRO-002-GM3)研究分为两个阶段,根据中期分析后的总体疗效和安全性选择Luveltamab剂量,研究者选择的化疗作为对照组。主要终点为PFS,入组已于2023年7月开始5。
二、PARP抑制剂耐药问题的克服
【768P】评估AsiDNATM联合PARPi在既往接受过至少6个月PARPi治疗的PSR OC患者中的疗效与安全性:一项开放标签、多中心、Ⅰb/Ⅱ期临床试验(RevoCAN)的初步结果
AsiDNATM是一种DNA损伤修复(DDR)抑制剂创新药,与PARPi联用有望克服PARPi耐药的问题。研究共纳入10例患者进行联合用药可行性探索和对CA-125的初步疗效评估。结果显示,在接受PARPi治疗出现生物学进展的患者中,AsiDNA + PARPi是安全的,根据CA-125标准评估为无缓解,根据RECIST标准评估10例患者中有1例CR和6例SD(n=3>6个月)6。
【821TiP】Ceralasertib+AZD5305治疗既往接受过PARPi治疗的晚期/转移性卵巢癌患者的Ⅰ期研究
Ceralasertib是一种选择性强效ATR抑制剂,CAPRI研究显示Ceralasertib联合奥拉帕利在BRCAm/HRD阳性的PARPi耐药卵巢癌中具有活性。AZD5305是一种高选择性强效PARP1抑制剂,AZD5305联合Ceralasertib在PARPi耐药的BRCAm乳腺癌和卵巢癌PDX模型中已证实持久的肿瘤消退,与奥拉帕利+Ceralasertib相比,AZD5305+Ceralasertib可能提供更好的治疗效果。
图3. Ceralasertib联合AZD5305作用机制
该模块化Ⅰ期开放标签试验的模块5评估Ceralasertib联合AZD5305在既往接受过PARPi治疗的PSR OC患者中的应用,剂量扩展队列患者须有已知或疑似BRCA、RAD51C/D或PALB2突变或HRD阳性状态。2023年4月开始在北美、欧洲和亚太地区约41个中心共招募150例患者7。
三、少见病理类型卵巢癌治疗
【747MO】Ⅱ期生物标志物导向平台研究BOUQUET的首个结果:Cobimetinib或Atezolizumab+贝伐珠单抗治疗持续性/复发性罕见上皮性卵巢癌
Cobimetinib是一种选择性MEK1/MEK2抑制剂,MAPK通路参与肿瘤发生、进展和耐药,罕见EOC中常见MAPK通路激活突变,既往研究已证实MEK抑制剂在LGSOC以及Cobimetinib在BRAF、NRAS和KRAS突变肿瘤中的活性。BOUQUET研究纳入可评估的持续性或复发性铂耐药罕见EOC,Cobimetinib队列总人群cORR为16%(3/19),DCR为42%(8/19),6个月PFS率41%;Cobimetinib单药在LGSOC和MLA(中肾样腺癌)患者(n=9)显示出有前景的活性,cORR 33%,DCR 89%,在重度预处理的LGSOC/MLA患者中有持久的临床获益(>6个月),该队列会继续进行扩展验证8。
四、复发或转移性宫颈癌治疗
【743MO】QL1706+紫杉醇+顺铂/卡铂±贝伐珠单抗1L治疗R/M CC的疗效和安全性:一项开放性、单臂、多中心、Ⅱ期研究
QL1706是抗PD-1 lgG4和抗CTLA-4 lgG1抗体的双功能Mabpair产物。该研究结果显示,无论CPS状态如何,QL1706+紫杉醇+顺铂/卡铂±Bev 1L治疗R/M CC均显示出良好的抗肿瘤疗效,队列1(不联合Bev)、队列2(联合Bev)和总人群中,确认的ORR分别为75.0%、76.7%和75.9%;DCR分别为100.0%、96.7%和98.3%;mPFS 分别为12.5个月、16.4个月和14.3个月,OS数据尚不成熟。未观察到新的安全性信号9。
表2. QL1706+化疗±Bev的疗效结果
【LBA9】InnovaTV 301:一项对比Tisotumab Vedotin与研究者选择的化疗用于2/3L R/M CC疗效的全球、随机化、开放标签、Ⅲ期研究
基于Ⅱ期innovaTV 204研究结果,ADC药物Tisotumab Vedotin(TV)已获FDA加速批准用于治疗化疗期间或化疗后疾病进展的R/M CC。InnovaTV 301研究共入组502例患者,对比TV与研究者选择的化疗用于R/M CC的疗效和安全性。结果显示,TV对OS的改善具有统计学显著性和临床意义(HR 0.70,降低死亡风险30%),还观察到一致的PFS和确认的ORR获益,安全性可管理。基于这些数据,TV可考虑作为1L系统治疗后进展的宫颈癌潜在的新的标准治疗10。
图4. 主要终点:OS
图5. 研究者评估的PFS
【757P】重组人5型腺病毒(H101)瘤内注射治疗R/M CC的疗效和安全性:一项前瞻性、开放标签、单臂研究
该研究纳入了接受过至少一线系统治疗或无法耐受化疗的P/R/M CC患者,给予H101瘤内注射,联合或不联合放疗或其他药物,主要终点是局部控制(LC)。2021年9月至2023年4月共入组53例患者,中位随访时间8个月。3个月LC率为73.5%,ORR 69.4%,DCR 81.6%,6个月和12个月 PFS 率分别为75.77%和59.66%,OS 率分别为92.94%和73.83%,中位PFS和OS未达到。未发现预期外安全信号,未发生治疗相关死亡。结果表明,H101是P/R/M宫颈癌病毒治疗的有力候选药物11。
五、复发性子宫内膜癌治疗
【741MO】 STRO-002-GM1 Ⅰ期剂量扩展:Luveltamab Tazevibulin(STRO-002, 一种抗FolRα ADC)在复发性EC中表现出临床活性
Luvelta(STRO-002)治疗FolRa表达≥1%的复发性EC表现出有前景的初步抗肿瘤疗效,其中FolRa>25%和FolRa≥1%患者的PR分别为29%和19%,DCR分别为86%和69%;安全性特征可预测且不良事件可控。STRO-002可能提供一种新的靶向治疗选择,值得在复发性EC中进一步探索12。
【LBA34】T-DXd用于经治的HER2表达实体瘤:全球、多中心、多队列、开放标签Ⅱ期DESTINY-PanTumor02研究结果
T-DXd(Trastuzumab deruxtecan)是一种HER2靶向ADC,已获批用于HER2阳性的乳腺癌和胃癌及HER2突变的NSCLC。DESTINY-PanTumor02研究分为7个队列,共纳入267例HER2表达(IHC 3+或2+)的患者。结果显示,总人群和IHC 3+患者的ORR分别为37.1%和61.3%,中位DOR分别为11.3个月和22.1个月,PFS分别为6.9个月和11.9个月,OS分别为13.4个月和21.1个月。T-DXd在子宫内膜癌、宫颈癌和卵巢癌队列中都表现出不错的客观缓解,尤其是在IHC 3+的HER2表达患者13。
图6. 客观缓解与缓解持续时间
参考文献:
1. Kathleen Moore, et al. 2023 ESMO. 745MO.
2. Lingying Wu, et al. 2023 ESMO. 753P.
3. G.E. Konecny, et al. 2023 ESMO. 754P.
4. G.E. Konecny, et al. 2023 ESMO. 756P.
5. Levine Cancer Institute, et al. 2023 ESMO. 818TiP.
6. Patricia PAUTIER, et al. 2023 ESMO. 768P.
7. Geoffrey l. Shapiro, et al. 2023 ESMO. 821TiP.
8. Isabelle Ray-Coquard, et al. 2023 ESMO 747MO.
9. Danbo Wang, et al. 2023 ESMO 743MO.
10. lgnace Vergote, et al. 2023 ESMO LBA9.
11. Qiying Zhang, et al. 2023 ESMO 757P.
12. Bhavana Pothuri, et al. 2023 ESMO 741MO.
13. Funda Meric-Bernstam, et al. 2023 ESMO LBA34.
声明:
本资讯由默沙东医学团队支持,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
审批号:MI-PD1-5229-CN
过期日:12/31/2023
查看更多