查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






胃癌是全球高发恶性肿瘤,尤其晚期患者预后不佳,传统化疗疗效有限,亟需探索新型生物标志物以优化治疗策略。近年来,Claudin18.2(CLDN18.2)作为胃癌治疗的新兴靶点备受关注,其在亚洲人群中的阳性率约为30%~40%,但不同人群分布数据及治疗后的动态变化仍需深入验证。2025年美国临床肿瘤学会(ASCO)年会公布的两项研究(摘要号4021和4047)分别聚焦西方人群胃食管腺癌(GEA)的CLDN18.2表达特征及人工智能对Claudin 18.2表达和免疫表型的预测价值,为靶向治疗人群筛选提供了关键证据。
中国医学论坛报社特邀北京协和医院周炜洵教授对研究数据进行深度解读,探讨CLDN18.2的临床转化价值及未来研究方向。
专家简介
周炜洵 教授
北京协和医院病理科主任医师
中华医学会病理学分会消化系统学组组长
中华医学会消化分会炎症性肠病协作组、中国抗癌协会肿瘤病理委员会胃癌中青年协作组等学术团体委员
《中华病理学杂志》编委
以消化道病理作为专业方向,对消化道肿瘤及炎症性疾病的诊断有丰富的经验
摘要号4021:西方人群胃食管腺癌中Claudin18.2的表达:与其他生物标记物的复合情况及预后价值
本研究旨在探讨西方局限性和转移性GEA人群中CLDN18.2的表达情况,以及其与其他生物标志物(如HER2状态、微卫星不稳定性(MSI)和PD-L1表达)的共表达情况。研究采用单中心、回顾性设计,纳入2019-2023年间诊断的405例局限性和转移性GEA患者。通过免疫组化(IHC)使用VENTANA CLDN18 [43-14A] RxDx Assay检测CLDN18.2阳性,阳性定义为≥75%的肿瘤细胞显示中到强度膜染色。同时,研究还评估了错配修复(MMR)状态、HER2状态(IHC/SISH)和PD-L1 CPS。截至2024年8月,研究收集了患者的基线特征和临床随访数据,以评估总生存期(OS)、无进展/无复发生存期(PFS/RFS)和复发后生存期(SAR)。
405例患者中,261例为局限性GEA,144例为转移性GEA,大多数患者为男性(71%),中位年龄65岁。59%的肿瘤为食管胃结合部肿瘤,41%为胃癌。研究发现,西方人群中局限性和转移性GEA的CLDN18.2阳性率为42%。错配修复缺陷(dMMR)、HER2阳性(TOGA标准)及PD-L1 CPS≥1的发生率分别为6%、16%、58%。CLDN18.2与HER2共阳性率为5%,与dMMR共阳性率为3%,其中50%的dMMR病例和1/3的HER2阳性病例中存在CLDN18.2阳性。CLDN18.2与PD-L1 CPS≥1/≥5/≥10共阳性率分别为23%、15%和9%。CLDN18.2阳性与局限性/转移性患者的RFS、PFS、OS及SAR均无显著关联(P>0.05)。PD-L1 CPS≥1的局限性患者复发后生存期(SAR)显著延长(HR=0.51,P=0.002),而CLDN18.2阳性和阴性患者之间的SAR无显著差异(HR=1.07,P=0.77)。
图. 在两个队列中,总生存期与CLDN18.2表达无关
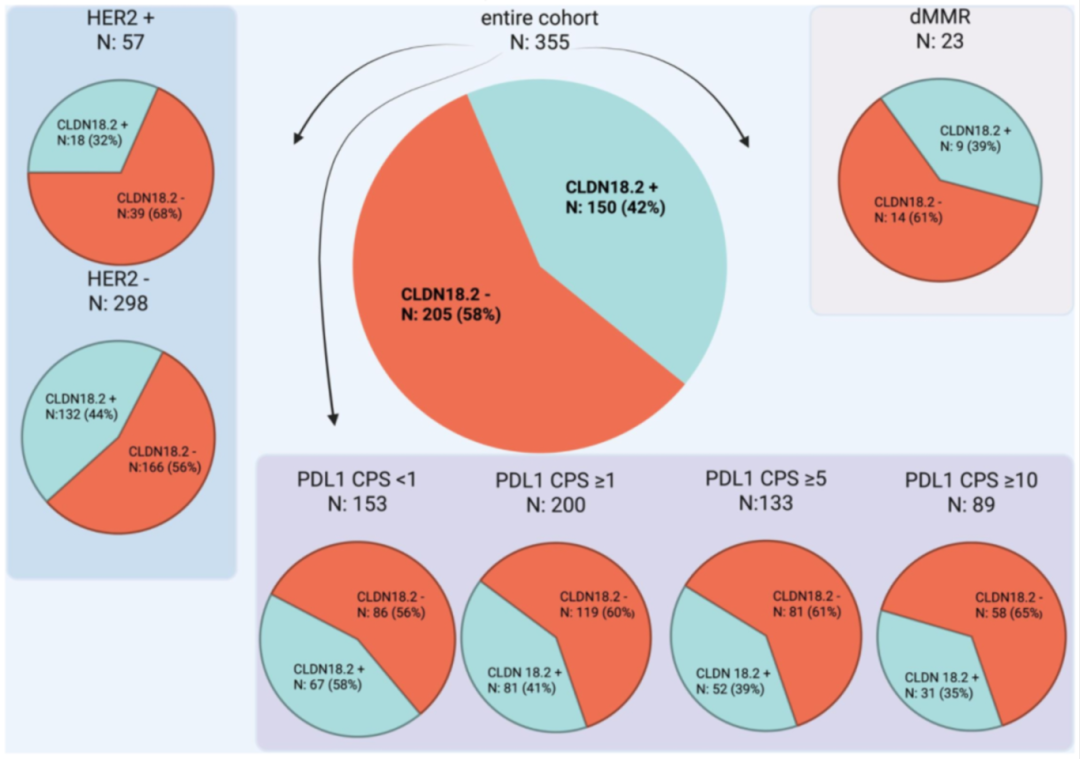
图. CLDN18.2阳性/阴性与HER2+/-、dMMR及不同PD-L1 CPS临界值(<1、≥1、≥5、≥10)的相关性比较
西方人群局限性和转移性GEA中CLDN18.2的阳性率为42%,dMMR、PD-L1 CPS≥1及HER2的阳性率分别为6%、58%、16%。值得注意的是,CLDN18.2阳性在约一半的dMMR和三分之一的HER2阳性病例中存在。然而,CLDN18.2阳性对局限性和转移性疾病的生存无显著影响。
专家点评
周炜洵教授:GEA是一种具有高发病率和死亡率的恶性肿瘤,其治疗面临诸多挑战,尤其是在不同人群中寻找有效的生物标志物以指导个体化治疗策略。本研究在西方人群中探讨CLDN18.2的表达情况及其与其他生物标志物(如HER2、MSI、PD-L1)的关系,对于跨人群治疗策略的制定具有重要的临床意义。
研究结果显示,西方人群中GEA的CLDN18.2阳性率为42%,与亚洲人群(40%)相近,这进一步支持了CLDN18.2作为跨人群治疗靶点的潜力。研究还发现CLDN18.2与HER2、dMMR、PD-L1等生物标志物存在一定的共表达情况,但共阳性率相对较低。值得注意的是,CLDN18.2阳性与患者的生存指标(RFS、PFS、OS、SAR)并无显著关联。
本研究结果不仅有助于验证CLDN18.2作为治疗靶点的潜力,还为未来的治疗分层提供了重要的依据。CLDN18.2作为一个相对独立的靶点,与其他生物标志物的相关性较低。这在临床实践中具有重要意义,它意味着对于CLDN18.2阳性的胃癌患者,大部分可以直接考虑基于生物标志物的状态来选择治疗策略。例如,CLDN18.2与HER2、dMMR的共阳性率较低(HER2+中33%、dMMR中50%),这表明大部分CLDN18.2阳性患者可能不重叠于现有靶向治疗(如抗HER2)或免疫治疗(如dMMR/MSI-H患者使用PD-1抑制剂)的优势人群。另一方面,对于患者治疗方案的选择,未来的研究可以考虑采用多中心前瞻性设计,以提高研究结果的可靠性和普遍性。同时,深入探索CLDN18.2与其他生物标志物之间的相互作用机制,以及开展基于CLDN18.2的靶向治疗策略的临床试验,将有助于进一步揭示其在GEA治疗中的潜在应用价值。
摘要号4047:基于人工智能预测Claudin 18.2表达和免疫表型以指导胃癌患者的治疗决策
本研究旨在开发一种基于人工智能(AI)的模型,通过分析胃癌患者的H&E染色切片预测CLDN18.2表达和免疫表型,以指导治疗决策。CLDN18.2是佐妥昔单抗联合化疗的临床相关靶点,传统检测方法(如免疫组化)存在样本不足、耗时长等局限性。研究采用Vision Transformer架构的多实例学习框架,利用459例患者的H&E切片(推导队列)训练模型,并在内部验证队列(381例接受一线免疫检查点抑制剂联合化疗或单纯化疗的患者)和外部验证队列(100例来自不同种族背景的患者)中评估其性能。通过AI分析全切片图像对免疫表型进行分层,进一步探索不同亚组患者的治疗反应差异。
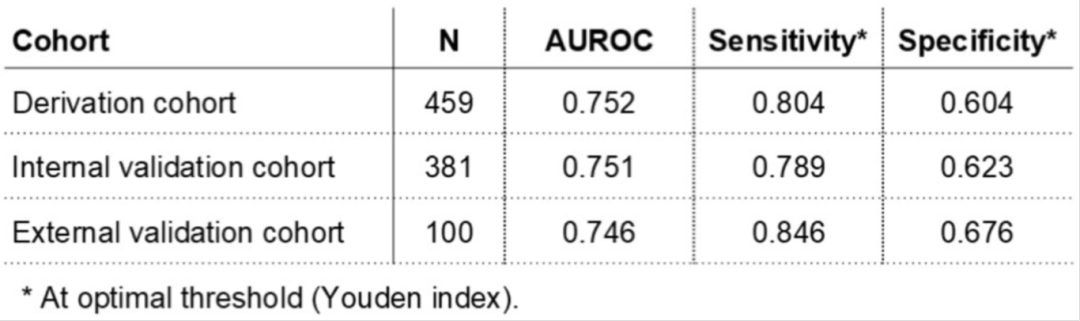
CLDN18.2阳性的患病率在推导队列中为43.4%,内部验证队列为37.3%,外部验证队列为26.0%。AI模型在推导队列中预测CLDN18.2表达的AUROC为0.753,敏感性和特异性分别为0.638和0.723。在内部和外部验证队列中,AUROC分别为0.752和0.746,具有类似的敏感性和特异性水平。在内部验证队列中,基于预测的CLDN18.2阳性和免疫表型状态,患者被分层为亚组。其中,预测为CLDN18.2阴性和炎症性免疫表型的亚组从免疫检查点抑制剂联合化疗中获益最大,与仅化疗组相比,PFS和OS的风险比分别为0.37(95% CI 0.17–0.78,P=0.009)和0.41(95% CI 0.19–0.88,P=0.021)。其他亚组的HR值也有所报告,但未达到统计学显著性。
表. CLDN18.2预测AI模型在衍生队列、内部和外部验证队列中的性能
该AI模型能够可靠地从常规H&E切片预测CLDN18.2表达,且在不同队列中表现一致。结合CLDN18.2表达和免疫表型的生存分析表明,AI分层可有效识别可能从免疫检查点抑制剂联合化疗中获益的特定亚组。这一方法为胃癌一线治疗的精准决策提供了潜在工具,尤其适用于传统检测受限的场景。
专家点评
周炜洵教授:胃癌是全球范围内常见的恶性肿瘤之一,其发病率和死亡率均居高不下。尽管近年来在诊断和治疗方面取得了一定进展,但晚期胃癌患者的预后仍然不容乐观。精准治疗是当前胃癌治疗的重要发展方向,其中生物标志物检测对于制定个性化治疗方案至关重要。然而,传统的生物标志物检测方法,如免疫组化,存在样本不足、成本高、耗时长等局限性,这在一定程度上限制了精准治疗的广泛应用。因此,探索新的检测方法和技术,以提高生物标志物检测的效率和准确性,对于改善胃癌患者的治疗效果具有重要意义。
本研究开发了一种AI模型,通过分析胃癌患者的H&E染色切片来预测CLDN18.2表达和免疫表型,以指导治疗决策。CLDN18.2是佐妥昔单抗联合化疗的临床相关靶点,其在胃癌中的表达情况对于治疗方案的选择具有重要指导意义。研究采用Vision Transformer架构的多实例学习框架,利用患者的H&E切片进行模型训练,并在内部和外部验证队列中评估其性能。结果显示,AI模型在预测CLDN18.2表达方面表现出较好的一致性和准确性,其AUROC值在推导队列、内部验证队列和外部验证队列中分别为0.753、0.752和0.746,敏感性和特异性也较为理想。这一结果表明,该AI模型能够可靠地从常规H&E切片预测CLDN18.2表达,为胃癌患者的治疗决策提供了新的工具。
此外,研究通过AI分析全切片图像对免疫表型进行分层,并探索了不同亚组患者的治疗反应差异。结果显示,预测为CLDN18.2阴性和炎症性免疫表型的亚组从免疫检查点抑制剂联合化疗中获益最大,与仅化疗组相比,PFS和OS的风险比显著降低。这表明,结合CLDN18.2表达和免疫表型的AI分层方法能够有效识别可能从免疫检查点抑制剂联合化疗中获益的特定亚组患者。这一发现为胃癌一线治疗的精准决策提供了潜在工具,尤其在传统检测处于临界的情况下,AI模型的应用可能具有更大的临床价值。未来的研究应进一步验证AI模型的准确性和可靠性,并探索其在临床实践中的最佳应用方式,以期为胃癌患者带来更多的治疗选择和更好的预后。
审校:北京协和医院 周炜洵教授
整理:中国医学论坛报 林颖
1. Filip Van Herpe, et al. Claudin-18.2 expression in gastro-oesophageal adenocarcinoma in a Westem population: Overlap with other biomarkers and prognostic value. 2025 ASCO 4021.
2. Hyung-Don Kim, et al. Artificial intelligence-based prediction of claudin 18.2 expression and immune phenotype to guide treatment decisions in patients with gastric cancer. 2025 ASCO 4047.
本文仅供医疗卫生专业人士参考
审核编码:MAT-CN-VYL-2025-00195
材料准备时间:2025-07-04
材料有效期:2026-07-04
查看更多