查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





癌症和心血管(CV)疾病是发达国家发病率最高的疾病。越来越多的证据表明,这些疾病通过共同的风险因素相互关联,与老年人群一致,并通过抗癌治疗对CV健康的一些有害作用在生物学上相互关联。新型癌症疗法显著改变了癌症预后,不会和传统抗癌治疗一样引起短期和长期心脏毒性作用。但新疗法还是可引起心力衰竭以外的非预期CV并发症。该ESMO共识文章提出定义与癌症或其治疗相关的CV毒性,并提供关于预防、筛查的指导,监测和治疗CV毒性。关于证据等级和推荐等级见表1。

1.
一般原则
1.1. 建议在癌症患者中筛查已知的CV风险因素;建议根据现行指南治疗已确定的CV风险因素[Ⅰ,A]。
1.2. 多种类型的癌症治疗,尤其是纵隔和左侧胸部放疗以及某些ChT和靶向药物,可显著影响心脏和血管系统,建议监测CV安全性[Ⅰ,A]。
1.3. 建议心脏病学家、肿瘤学家、血液学家和放射肿瘤学家之间进行早期且密切的合作,以确保CV始终健康并避免因不必要的情况而中止癌症治疗[Ⅲ,A]。
2.
抗癌治疗前筛选
2.1. 在接受潜在心脏毒性化疗(ChT)的患者中常规应用心脏生物标志物(hs-cardiac troponins,[TnI或TnT、BNP或NT pro-BNP])的情况尚不明确。然而,对于高风险患者(预先存在显著CVD)和接受高剂量心脏毒性ChT(如蒽环类药物)的患者,应考虑基线时对患者进行此类心脏生物标志物测量[Ⅲ,A]。
2.2. 对于癌症诊断需要接受潜在心脏毒性治疗的患者,建议进行基线心电图(ECG)检查,包括测量心率QTc[Ⅰ,A]。
2.3. 在计划接受心力衰竭(HF)或左室功能障碍(LVD)相关抗癌治疗的患者中,建议在基线时根据公认的综合成像实践对左心室射血分数(LVEF)和舒张功能进行评价[Ⅰ,A]。
3.
一级预防治疗
有少量研究表明,血管紧张素转换酶抑制剂(ACE-Is)、血管紧张素受体阻滞剂(ARBs)或选择性β受体阻滞剂(BBs),如卡维地洛和nebivolol,可能是降低心脏毒性风险的首选药物(表2)。

3.1. 这些研究提供了适度临床获益的证据,但总体结果是不同研究人群的混合反应,包括许多低风险患者、不同的抗癌治疗和临床试验终点。需要进一步的研究来描述有效预防毒性的最佳患者选择和治疗方案,重点关注基于ChT方案和已知CV风险因素发生心脏毒性风险最高的患者(表3)。
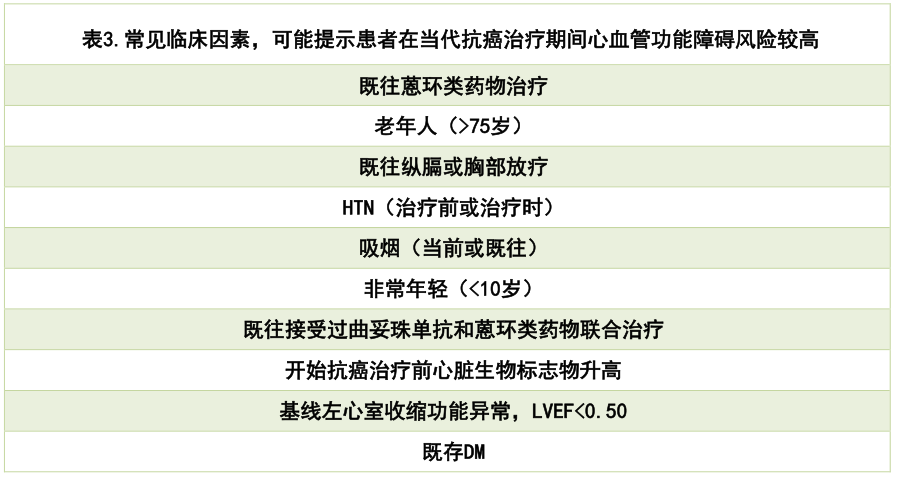
3.2. 对于LVEF正常且有CV风险因素、计划接受已知心脏毒性药物抗癌治疗的患者,尤其是暴露于多种心脏毒性药物的患者,预防性使用ACE-I或ARB(如果对ACE-I不耐受)和/或选定的BB可考虑减少心脏毒性的发生[Ⅱ,B]。
3.3. 有高脂血症证据的患者在活性抗癌治疗期间可能从治疗中获益,尤其是心脏毒性ChT[Ⅱ,C]。
4.
癌症治疗期间:心脏安全性监测
4.1. 建议对有心脏并发症风险的癌症患者进行医学成像时采用以下一般原则,尤其是定期评估LV收缩功能时:4.1(a)建议使用质量控制的高重现性、定量容积、非辐照成像(定量2D/3D超声心动图和CMR成像提供了这些特征)[Ⅰ,A]。4.1(b)对于每例患者,建议在同一机构采用相同的成像模式进行系列检测[Ⅰ,A]。4.1(c)如果可用,可考虑使用LV GLS成像进行LV收缩功能的基线和连续监测[Ⅲ,C]。
4.2. 接受蒽环类药物治疗的LVEF正常的无症状患者应进行风险分层监测和心脏毒性的早期检测,包括:4.2(a)定期(每3e6周或每个周期前)测量肌钙蛋白I或肌钙蛋白T、BNP或NT pro-BNP(如果这些生物标志物可用),使用相同的机构实验室,可接受的99%正常参考范围上限作为异常阈值[Ⅲ,C]。4.2(b)建议在多柔比星250 mg/m2或其等效蒽环类药物累积剂量给药后、250 mg/m2以上每次增加约100 mg/m2(或表柔比星约200 mg/m2)后以及治疗结束时(即使<400 mg/m2),按照一般成像原则重新评估LV功能[Ⅰ,A]。
4.3. 根据FDA目前对接受曲妥珠单抗辅助治疗的无症状非转移性患者的建议,应考虑进行常规监测,包括每3个月进行一次心脏成像,以早期检测心脏毒性。但是,该策略在无LVD早期证据的低CV风险患者中的有效性尚未得到证实,相反,高风险患者可能需要更密切的监测[Ⅱ,B]。
4.4. 心脏生物标志物评估可被认为是接受基于抗HER2辅助治疗的患者心脏安全性监测的一种有价值的工具[Ⅲ,C]。
4.5. 接受基于抗HER2的转移性疾病治疗的无症状患者应对CV毒性进行一般监测,可能包括定期心脏体格检查、心脏生物标志物和/或心脏成像[Ⅰ,B]。
4.6. 对于接受与全身性HTN风险相关的癌症治疗的患者,尤其是基于VEGF的治疗,建议建立基线BP测量和连续BP监测,并监测CV毒性的早期检测,可能包括定期心脏体格检查、心脏生物标志物和/或心脏成像[Ⅰ,A]。
5.
无症状、新发实验室检查异常
(或临床前毒性)
5.1. 在正在接受蒽环类药物治疗的无症状患者中,LVEF从基线降低≥10%至50%,或LVEF降低至≥ 40%但< 50%,建议进行以下评价:
心脏病学会诊(最好是心脏肿瘤学专家)。
如果尚未处方,考虑开始心脏保护治疗(acei、ARB和/或BB)。如果伴随冠状动脉疾病,可考虑使用他汀类药物。
蒽环类药物每次给药后,考虑心脏生物标志物(BNP或NT-proBNP和TnI或Tnt)和以心脏为重点的体格检查。
以蒽环类药物为基础的ChT交替给药后重复LVEF评估。
如果计划进一步开展基于蒽环类药物的ChT,应讨论继续使用蒽环类药物的获益-风险评估以及非蒽环类药物治疗方案的选择,并应考虑使用右丙亚胺和/或脂质体阿霉素[Ⅲ,A]。
5.2. 正在接受曲妥珠单抗治疗的无症状患者,LVEF较基线下降10%或LVEF下降至40%,但<50%,建议进行以下评价:
心脏病学会诊(最好是心脏肿瘤学专家)。
如果尚未处方,考虑开始心脏保护治疗(acei、ARB和/或BB)。
考虑每月进行一次心脏生物标志物(BNP或NT-pro BNP和TnI或Tnt)检测,并定期进行以心脏为重点体格检查,以持续监测心脏毒性。
如果停用曲妥珠单抗,在3-6个月内重复LVEF检查,如果LVEF正常至 > 50%,则重新开始曲妥珠单抗治疗。
无症状性LVEF轻度降低时,根据情况可继续使用曲妥珠单抗治疗[Ⅲ,A]。
5.3. 正在接受任何心脏毒性抗癌治疗的无症状患者,LVEF正常但GLS较基线评估时平均降低(相对降低12%或溶质性降低5%),应考虑以下评价/治疗:
如果尚未给药,考虑开始心脏保护治疗(acei、ARB和/或BB)。
每3个月重复测量LVEF/压力,除非需要进行心脏体格检查或出现症状(如果发生这种情况,应重复测量LVEF/应变,并确定是否存在心脏毒性)。
不应仅根据左室压力的变化改变挽救性ChT[Ⅲ,B]。
5.4. 正在接受心脏毒性抗癌治疗且心肌肌钙蛋白升高的无症状患者,应考虑采取以下措施:
心脏病学会诊,(最好是心脏肿瘤学专家)。
考虑使用超声心动图进行LVEF和GLS评估。
评估并排除缺血性心脏病并发症。
如果尚未处方,考虑开始心脏保护治疗(acei、ARB和/或BB)。
对于接受基于蒽环类药物的ChT的患者,考虑开始右雷佐生治疗。
如果仅发生心脏生物标志物轻度升高而无显著LVD,则可以继续抗癌治疗而不中断[Ⅲ,C]。
6.
临床心功能障碍
6.1. LVEF异常<50%但≥40%的患者,推荐潜在导致心脏毒性治疗前使用ACE-I、ARB和/或BB类药物[Ⅰ,A]。
6.2. 对于LVEF<40%的患者,不建议使用蒽环类药物治疗,除非没有有效的替代抗癌治疗选择[Ⅳ,A]。
6.3. 对于接受任何心脏毒性药物治疗的患者,如出现(但不限于)窦性心动过速、体重快速增加、呼吸困难、外周水肿或腹水等原因不明的体征和症状,建议心脏科会诊,重新评估LVEF并可能测量心脏生物标志物[Ⅲ,a]。
6.4. 对于正在接受曲妥珠单抗(或任何HER2靶向分子治疗)治疗且有HF体征和症状的患者,或LVEF<40%的无症状患者,建议采用与LVEF≥40%相同的评估方法。此外,应暂停曲妥珠单抗(或任何基于HER2的治疗)给药,直至心脏状态稳定。应与多学科团队和患者讨论继续治疗的风险和获益[Ⅰ,A]。
6.5. 对于中断曲妥珠单抗治疗(或任何HER2靶向分子治疗)、LVEF≥40%和/或HF体征和症状已消退的患者,应考虑恢复曲妥珠单抗治疗,支持如下:
继续HF药物治疗和持续的心脏病治疗。
定期心脏生物标志物评估。
正在进行的治疗期间定期评估LVEF[Ⅲ,B]。
6.6. 对于已中断曲妥珠单抗治疗(或任何HER2靶向分子治疗)、HF体征和症状未消退和/或LVEF仍 < 40%的患者,如果无替代治疗选择,可考虑恢复曲妥珠单抗治疗。应与多学科团队和患者讨论癌症与HF预后的风险-获益评估[Ⅳ,C]。
6.7. 对于接受舒尼替尼(或其他基于VEGF的治疗)治疗且出现HF体征和症状的患者,建议进行BP控制评估和优化,并考虑LVEF和/或心脏生物标志物的测量。此外,应中断舒尼替尼(或其他基于VEGF的治疗)给药。应对患者进行评估,以确定是否适合重新开始这些治疗[Ⅲ,A]。
7.
治疗后:抗癌治疗存活者
7.1. 对于已接受心脏毒性药物治疗且心脏功能正常的无症状患者,应考虑在治疗后6-12个月、2年以及此后可能定期进行心脏生物标志物和潜在心脏影像学检查,以筛查是否出现新的无症状性左心室功能障碍[Ⅲ,B]。
7.2. 对于因曲妥珠单抗(或任何HER2靶向分子治疗)、蒽环类药物或其他抗癌治疗而发生LVD或HF的患者,无论LVEF或症状是否改善,均应继续进行CV治疗,包括ACE-I、ARB和/或BB药物治疗和定期心脏病学审查(如无症状,每年一次)。在经过一段时间的稳定、无活动性心脏风险因素和无进一步活性抗癌治疗后,才考虑退出基于HF治疗的决策[Ⅲ,B]。
7.3. 对于有纵隔胸部放疗(RT)史的患者,建议对冠状动脉疾病(CAD)和缺血以及瓣膜病进行评估,即使是无症状的,也应从治疗后5年开始,至少每3-5年评估一次[Ⅰ,A]。
7.4. 应鼓励接受抗癌治疗的患者和长期癌症生存者定期运动[Ⅲ,B]。
7.5. 应鼓励接受抗癌治疗的患者和长期癌症生存者保持健康的饮食习惯(与重制谷物、加工和红肉以及高脂肪食物相比,大量摄入新鲜水果/蔬菜和全谷物)并保持正常体重[Ⅳ,B]
8.
免疫检查点抑制剂(ICI)相关的CV毒性
8.1. 对于在接受ICI治疗期间(或近期完成后)出现新的CV症状或在ECG上偶然发现有任何心律失常、传导异常或超声心动图显示左室功能不全(LVSD)的患者,应及时对ICI相关CV毒性,尤其是心肌炎和其他常见鉴别诊断进行进一步适当的检查(ECG、肌钙蛋白、BNP或NT-pro-BNP、C反应蛋白、病毒滴度、超声心动图+GLS、心脏MRI)[Ⅳ,C]。
8.2. 如果高度怀疑诊断且其他检查结果为阴性,则应考虑使用心内膜心肌活检进行诊断[Ⅳ,C]。
8.3. 怀疑或确认ICI相关心肌炎时,应暂停ICI进一步治疗,并及时开始高剂量皮质类固醇(甲泼尼龙1000 mg/d,随后口服泼尼松1 mg/kg/d)治疗。应继续使用皮质类固醇,直至症状消退和肌钙蛋白、LV收缩功能和传导异常恢复正常[Ⅳ,C]。
8.4. 对于类固醇难治性或高级别心肌炎伴血流动力学不稳定,应考虑其他免疫抑制治疗,如抗胸腺细胞球蛋白、英夫利昔单抗(HF患者除外)、吗替麦考酚酯或阿巴西普[Ⅳ,C]。
8.5. 对于心肌病和/或HF患者,应提供指南指导的适当药物治疗和血流动力学支持[Ⅳ,C]。
8.6 对于房性或室性快速性心律失常或心脏传导阻滞患者,应根据指征提供适当的药物和支持治疗[Ⅳ,C]。
8.7. 如果出现任何临床心肌炎,应永久停止ICI治疗。在没有可用的替代抗肿瘤治疗的情况下重新开始ICI治疗的决定需要通过多学科讨论个体化,考虑癌症状态、对既往治疗的反应、心脏毒性的严重程度、免疫抑制治疗的毒性消退和权衡风险和获益后的患者偏好。如果需要重新开始ICI治疗,可考虑使用抗PD-1药物,并密切监测心脏毒性的发展[Ⅴ,C]。
未来方向和结论
应权衡抗癌治疗导致的潜在CV损伤相关问题与潜在获益,包括OS获益。癌症患者的CVD是复杂的,且对其管理和治疗也是因人而异的。心脏肿瘤学的范围很广,不仅包括预防、检测、监测、治疗与抗癌治疗相关的CV毒性,还包括探索对CV健康影响极小的新型抗癌治疗。在癌症生存者中纳入监测策略将有助于预防与肿瘤治疗相关的潜在长期CV发病率和死亡率,更重要的是,应将CV健康和抗癌治疗转化为更好的CV和癌症临床结局。
来源:多读指南

查看更多