查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肿瘤异质性是恶性肿瘤的特征之一,是指肿瘤在生长过程中,经过多次分裂增殖,其子细胞呈现出分子生物学或基因方面的改变,从而使肿瘤的生长速度、侵袭能力、对药物的敏感性、预后等各方面产生差异。卵巢癌是妇科恶性肿瘤死亡的主要原因,目前其治疗方法已经发展成为一个复杂的框架,旨在反映卵巢癌的空间和时间异质性,卵巢癌是一种包含几种亚型的疾病。这些亚型中的分子异质性导致对常规铂类化疗不同程度的固有耐药性。近期,发表在Nat Rev Clin Oncol杂志上的一篇综述总结了卵巢癌的临床和生物学异质性以及它如何形成并继续形成治疗算法,并定义了当前的治疗前景[1]。现本文聚焦于“卵巢癌的临床、组织学和病理学异质性”予以整理报道。
卵巢癌是一种高度异质性的实体肿瘤,包括具有不同组织病理特征和临床行为的各种亚型(图1)。肿瘤进化分析揭示,癌细胞的可塑性导致了多样化的表型谱。在卵巢癌中,这种异质性限制了在不同亚型之间建立肿瘤分层和预后分类的能力。关于细胞起源的数据,前驱病变和癌症相关通路的改变可以提供预后信息,并揭示治疗策略的潜在靶点(图2)。详细的细胞和免疫组学分析也展示了在从浆液性输卵管上皮内癌前病变到癌症早期阶段的免疫耐受性变化,以及随着肿瘤进展和转移,免疫细胞减少的情况。基于DNA甲基化的卵巢癌分层已经证明了应用细胞起源特异性癌症甲基化来区分肿瘤亚型的潜力。这种分层方法结合了组织学亚型、转录特征、基因组不稳定性指数以及总生存期(OS)等多个维度。技术和算法的不断进步以及新方案的实施在改善卵巢癌管理和检测方面发挥着重要作用,进一步推动了这一领域的发展。
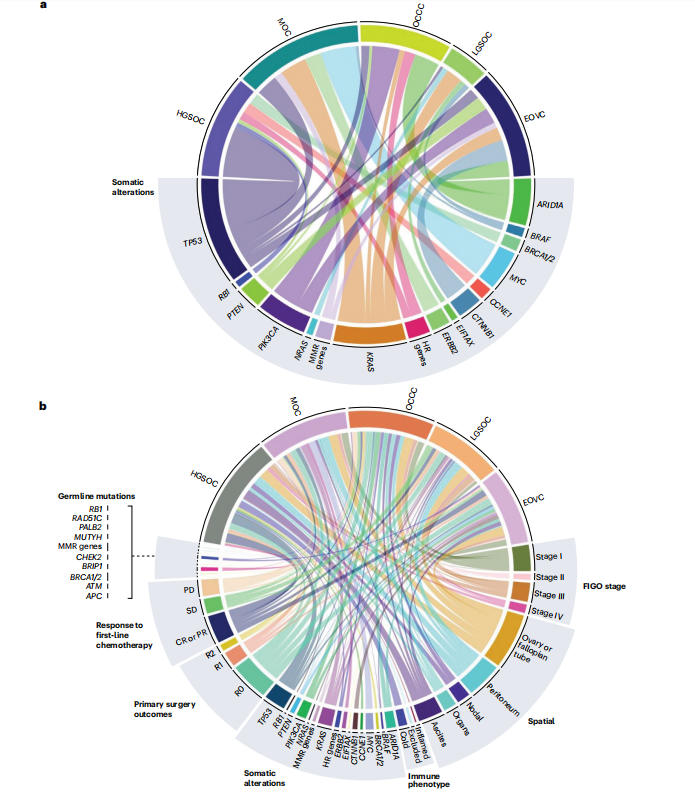
图1a:该图描绘了不同卵巢癌亚型中最重要的体细胞改变,图1b:卵巢癌亚型与其不同分子改变、临床特征和结果之间的关系
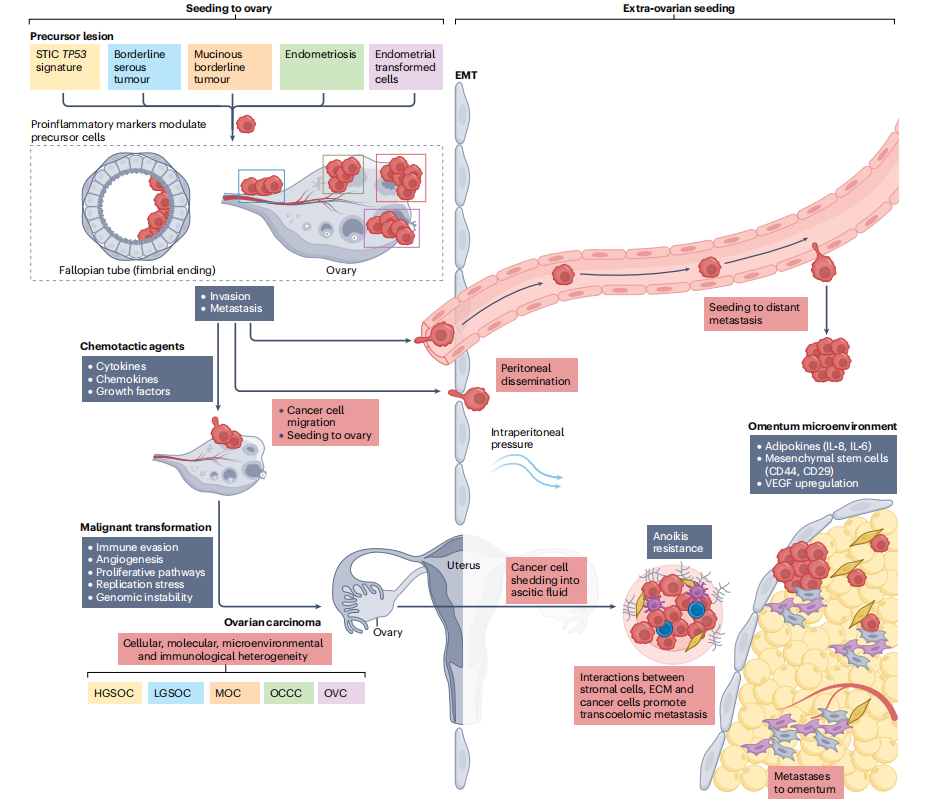
图2:卵巢癌前驱病变的发展过程
世界卫生组织(WHO)2020年的分类根据组织学、免疫组化和分子分析,定义了至少五种主要类型的卵巢癌:高级别浆液性卵巢癌(HGSOC)、子宫内膜样卵巢癌(EOVC)、卵巢透明细胞癌(OCCC)、低级别浆液性卵巢癌(LGSOC)和粘液性卵巢癌(MOC)。其他较为罕见的类型包括肾样癌、混合性癌和高钙血症型卵巢小细胞癌(SCCOHT)。值得注意的是,浆液粘液性癌已被归类为子宫内膜样癌的一个亚型。国际妇产科联盟(FIGO)分级系统是卵巢癌分级和分期最常用的标准。FIGO分级评估肿瘤细胞的分化程度,而FIGO分期描述了肿瘤在体内的扩散范围。通过应用这个系统,可以将卵巢癌分为预后相关的组别,指导选择合适的治疗方法。
HGSOC是卵巢癌中最常见的亚型(70%),大多数患者在晚期才被诊断,并且预后通常不佳[2]。据推测,HGSOC可能由浆液性输卵管上皮内癌前体细胞和输卵管上皮细胞发展而来,这些细胞携带TP53相关的突变特征[3]。一项涉及数千个非恶性输卵管上皮细胞和HGSOC细胞的广泛单细胞RNA测序研究揭示了各种分泌细胞类型与HGSOC中的表型多样性之间的稳健相关性,这种相关性可追溯到起源细胞的遗传特征[3]。因此,确定输卵管表面上皮中的前驱病变对于制定预防策略(如,预防性输卵管切除术)非常重要。
EOVC是第二常见的卵巢癌亚型(10%),通常表现为单侧实体肿块。子宫内膜异位症可能是EOVC的前驱病变,且该亚型通常与子宫内膜癌同步发生。近十年来,女性生殖道内致癌微生物的生态失调被认为在EOVC的发病机制中发挥了重要作用[4]。
OCCC在北美占卵巢癌的6%~10%,在东亚的患病率更高,在日本占25%~30%[5]。与HGSOC相比,OCCC通常在较年轻的年龄出现,并且往往对铂类药物具有耐药性,淋巴结转移的发生频率也更高[6]。研究人员通过对大量患者(n = 421)进行基因组和转录组特征分析,确定了OCCC的两个亚组[7]。经典亚型是最常见的(占总人群的83%),往往在较早的阶段出现,并且经常与子宫内膜异位症相关。‘HGSOC样’OCCC通常与子宫内膜异位症无关,往往在晚期被诊断,并且预后比经典型OCCC更差。这种亚型分类需要前瞻性验证,以明确OCCC亚型及其在临床实践中的相关性[8]。
LGSOC是一种罕见的亚型(5%),起源于腺纤维瘤或交界性肿瘤。LGSOC的发病具有双峰年龄分布,主要发生于20-30岁和50-60岁的人群。与HGSOC相比,LGSOC对患者包括铂类药物方案在内的化疗反应较差。尽管其生物学特性使得疾病进展整体上较为缓慢,但仍有一些病例可能具有侵袭性。此外,LGSOC的雌激素和孕激素受体表达水平高于HGSOC[9,10]。
MOC(3%~4%)是一种由粘蛋白分泌细胞衍生的异质性肿瘤类型。由于这些细胞在非恶性卵巢组织中不存在,因此学者们提出了多种理论来解释其组织发生,有必要将MOC与转移性粘液癌(Krukenberg瘤)区分开来。大多数MOC在育龄期女性中被诊断出,并且通常处于早期阶段,这使得生育保留手术成为这种情况下的常见的治疗方法。然而,由于MOC对化疗的敏感性不足,如果MOC在晚期被诊断,患者预后较差[11,12]。
SCCOHT是一种罕见的亚型,占所有卵巢肿瘤的比例不到0.01%。该亚型具有很高的侵袭性,通常发生在40岁以下女性中[13]。其组织发生尚不明确,但卵母细胞被认为可能是起源细胞[14]。许多患者会出现高钙血症,这可能与甲状旁腺激素相关蛋白有关。在分子水平上,SCCOHT的特征是SWI/SNF染色质重构复合体的SMARCA2和SMARCA4亚基同时丢失。SCCOHT的诊断可能具有挑战性,因此鼓励咨询妇科病理学家。鉴于几乎所有SCCOHT都携带SMARCA4的功能缺失突变,免疫组化检测转录激活因子BRG1(它编码的蛋白质)可以协助确立诊断[13]。
参考文献:
1.Veneziani Ana C. et al. Heterogeneity and treatment landscape of ovarian carcinoma. Nat Rev Clin Oncol. 20, 820-842(2023).
2.Permuth-Wey, J. & Sellers, T. A. Epidemiology of ovarian cancer. Cancer Epidemiol. 472, 413-437 (2009).
3.Hu, Z. et al. The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells. Cancer Cell 37, 226-242.e7 (2020).
4.Chen, S. et al. A review of the clinical characteristics and novel molecular subtypes of endometrioid ovarian cancer. Front. Oncol. 11, 668151 (2021).
5.Zhu, C. et al. Clinical characteristics and prognosis of ovarian clear cell carcinoma: a 10-year retrospective study. BMC Cancer 21, 322 (2021).
6.Montag, A. G. et al. Ovarian clear cell carcinoma. A clinicopathologic analysis of 44 cases. Int. J. Gynecol. Pathol. 8, 85-96 (1989).
7.Bolton, K. L. et al. Molecular subclasses of clear cell ovarian carcinoma and their impact on disease behavior and outcomes. Clin. Cancer Res. 28, 4947-4956 (2022).
8.Lheureux, S. Multi-omics uncovering diferent faces of clear cell ovarian cancer. Clin. Cancer Res. 28, 4838-4839 (2022).
9.Manning-Geist, B. et al. MAPK pathway genetic alterations are associated with prolonged overall survival in low-grade serous ovarian carcinoma. Clin. Cancer Res. 28, 4456-4465 (2022).
10.Veneziani, A. C. & Oza, A. M. Taking the road less traveled: following molecular trail markers. Clin. Cancer Res. 28, 4357-4359 (2022).
11.Morice, P., Gouy, S. & Leary, A. Mucinous ovarian carcinoma. N. Engl. J. Med. 380, 1256-1266 (2019).
12.Babaier, A. & Ghatage, P. Mucinous cancer of the ovary: overview and current status. Diagnostics 10, 52 (2020).
13.Tischkowitz, M. et al. Small-cell carcinoma of the ovary, hypercalcemic type-genetics, new treatment targets, and current management guidelines. Clin. Cancer Res. 26, 3908-3917 (2020).
14.McCluggage, W. G., Witkowski, L., Clarke, B. A. & Foulkes, W. D. Clinical, morphological and immunohistochemical evidence that small-cell carcinoma of the ovary of hypercalcaemic type (SCCOHT) may be a primitive germ-cell neoplasm. Histopathology70, 1147-1154 (2017).
声明:本文的发布由阿斯利康提供支持,仅供医疗卫生专业人士参考
审批编号:CN-133823
有效期至:2025-4-17
查看更多