查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





通讯员 罗苏珊 复旦大学附属华山医院神经内科
2018世界肌病学会第23届国际年会开幕式上,主席Thomas Voit教授在致辞中,即兴奋得表达了对于近年来基因治疗在神经肌肉病临床试验中取得的好成绩的喜悦和期待。在长期匮乏有效治疗手段的神经肌病研究领域,这无疑是振奋研究者心弦的重大喜讯。以脊肌萎缩症和杜氏肌营养不良为例,2017至今多有高质量临床研究工作发表(图1)。笔者以2018年10月3日晚关于“Precision Genetic Medicines for Neuromuscular disease”(神经肌肉疾病的基因精准治疗)专场发言内容进行学习和提炼,供神经肌病同道分享。

图1 基因治疗在SMA患者临床研究中的初步结果
继2017年基因治疗在脊肌萎缩症(Spinal muscular atrohpy, SMA)临床试验取得的好成绩后[1],目前神经肌病研究团队重点聚焦于杜氏肌营养不良的基因治疗。以美国国家儿童医院J.R. Mendell教授和Serepta治疗公司为首的研究团队,展示了这些年对于杜氏肌营养不良(Duchenne Muscular dystrophy, DMD)及LGMD等肌营养不良的杰出研究工作。肌营养不良的基因精准治疗,依据编辑工具和靶向对象的不同可以分为三类:1)RNA靶向治疗(采用PMO或PPMO实现外显子跳跃);2)基因治疗(基因替代-Mini-dystrophin,GALGT2);3)在体基因编辑。
(1) RNA靶向治疗主要采用的工具是反义寡核苷酸(antisense oligonucleotides, AOs)[2],有助于DMD基因截短突变携带者的外显子跳跃治疗。PMO-AOs全称为Phosphorodiamidate morpholino oligomer-吗啉基寡核苷酸,可用于阻碍其他分子与特定核酸序列的结合,阻挡RNA上约25个碱基的区域,作为重要的RNA靶向干预手段广泛用于小鼠、斑马鱼等动物模型。PPMO是在原PMO基础上进行化学修饰,以提高进入细胞内的效率。在体使用靶向设计的PMO或PPMO可保留DMD动物模型及患者Dystrophin基因的主要读码框,保存有功能的袖珍dystrophin蛋白,从而减少部分突变产生的肌营养不良的恶性结果。经过临床前期长达30年的研发周期,目前Sarepta公司有三种用于DMD外显子跳跃的符合临床使用标准的PMOs:Eteplirsen,Golodirsen以及Casimersen[3] (图2) 。其中在12个DMD孩子使用Eteplirsen长达5年后的随访中发现:以FVC%p为评估指标的呼吸肌退化速度仅为DMD常模的一半[4]。虽然还在随访早期,但无疑对于致残率极高的DMD患者是一个振奋的讯息(图3)。
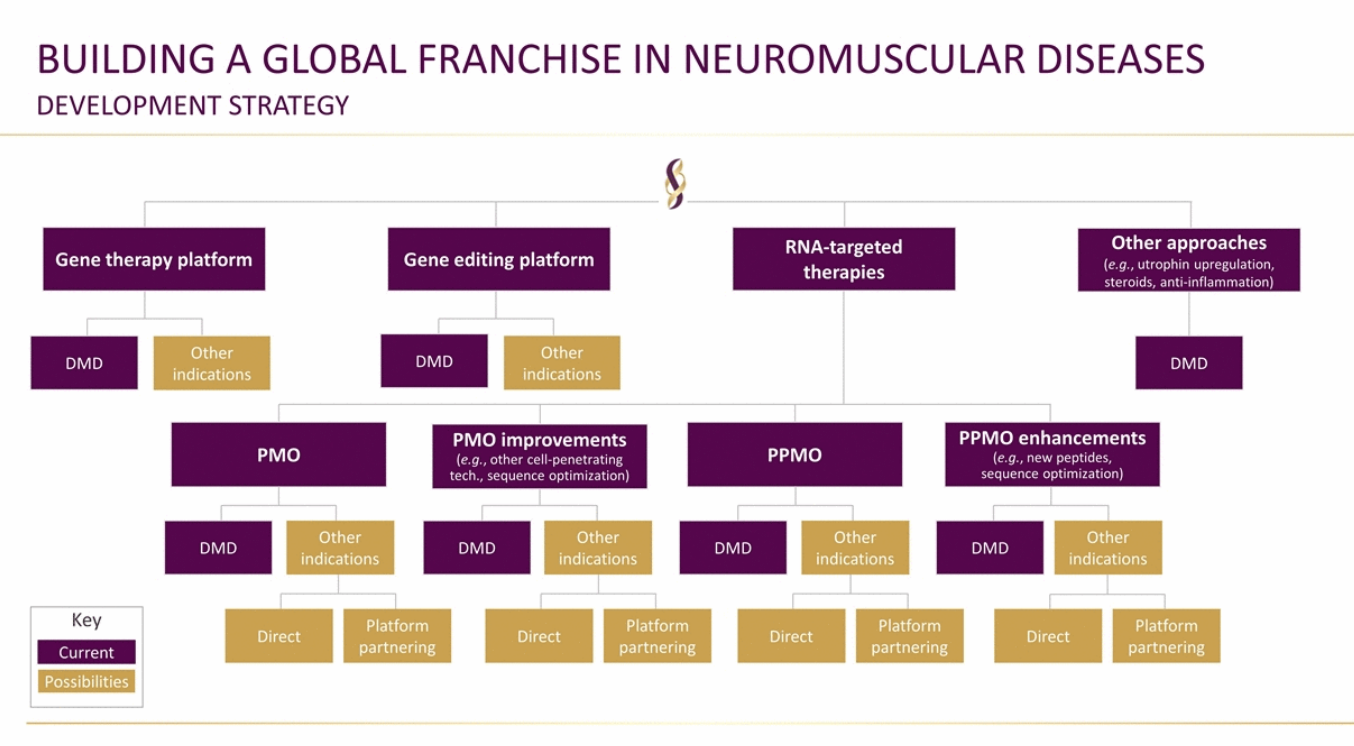
图2 目前Sarepta所搭建的基因治疗工具平台
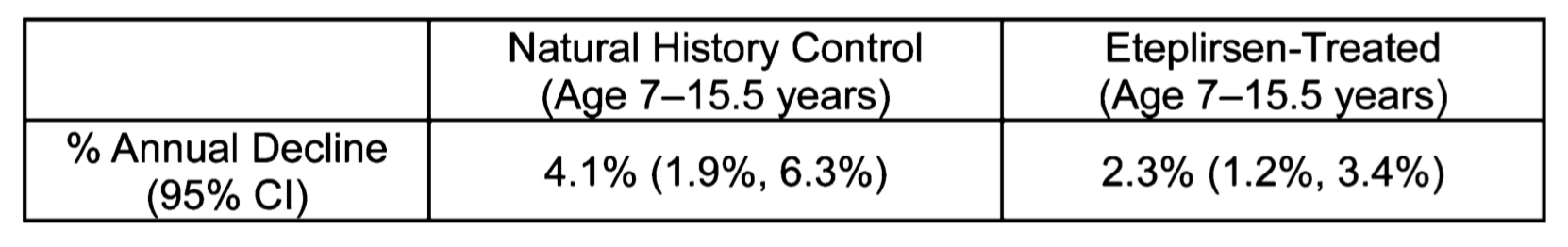
图3 Eteplirsen治疗DMD患者五年肺功能随访
(2) 基因治疗探索主要包括mini-dystrophin表达及替代治疗(Surrogate expression: GALGT2)。由于AAV不整合入宿主细胞基因组,仅在细胞核内形成episome,因此以AAV为基因治疗载体有很好的安全性。由于DMD患者会同时出现心脏和骨骼肌受累,因此在AAV的启动子区融合了α-MHC(α-myosin heavy chain)增强子及MCK(muscle creatine kinase)调节域,以提高心肌和骨骼肌靶向治疗的特异性[5]。由于AAV基因载体容量有限,而Dystrophin是一个巨型蛋白,早在1995年就有文献报道一个携带DMD基因Exon 17-48删失突变的患者到61岁仍能保持行走能力[6],因此将“精华版”mini-dystrophin读码序列植入AAVrh74-a-MHC-MCK载体,可以很好实现靶向心肌及骨骼肌的DMD基因治疗。这一载体在mdx小鼠模型的治疗探索中,取得了不错成果:降低肌酶、提高肌力,存在很好的组织特异性。非人灵长类动物经系统给药后,可见肌肉组织高表达,且未产生显著的自身抗体 (Sarepta on file)。
替代治疗(Surrogate expression: GALGT2),是指不直接表达缺陷的蛋白dystrophin,而是替代性过表达GALGT2 – 一种位于神经肌肉接头的UDP-GalNAc:β1,4-N-乙酰氨基半乳糖基转移酶,能阻断mdx小鼠的肌营养不良进程[7]。而这一替代基因治疗方法,不仅对于DMD治疗有临床研究意义,亦有可能给其他肌细胞膜蛋白病如LGMD等患者带来获益[8]。
(3) 在体基因编辑是指借用病毒载体将基因编辑工具带入体内实现“在体纠正”。2018年Texas大学的Eric N. Olson教授团队首次尝试在DMD狗模型上进行DMD基因exon50体内剪切探索(图4),结果发现:经过肌肉局部注射6周或系统给药8周后,肌肉dystrophin表达上调3%-90%不等,而心肌有非常高的表达,治疗组狗模型的肌肉病理上均有坏死细胞及炎性浸润的减少。尽管在体基因治疗的安全性仍值得进一步探索和随访,但初步研究的阳性结果给神经肌肉病的基因精准治疗提供了新的希望[9]。

图4 2018年发表的DMD狗模型在体基因编辑治疗探索
参考文献:
[1] Jerry.R. Mendell, Samiah AI-Zaidy, Richard Shell, et al. Single-dose Gene-replacement Therapy for spinal muscular dystrophy. N Eng J Med 2017;377:1713-1722.
[2] Linda J Popplewell, Capucine Trollet, George Dickson, et al. Design of Phosphorodiamidate Morpholino Oligomers (PMOs) for the induction of Exon skipping of the Human DMD gene. Mol Ther. 2009; 17(3):554-561.
[3] Yuko Shimizu-Motohashi, Terumi Murakami, En Kimura, et al. Exon skipping for Duchenne muscular dystrophy: a systemic review and meta-analysis. Orphanet J Rare Dis. 2018;13:93.
[4] T.Bernard Kinase, Oscar H. Mayer, Petra W. Duba, et al. Long-term pulmonary function in Duchenne Muscular Dystrophy: Comparison of Eteplirsen-Treated Patients to Natural history. J Neuromuscul Dis. 2018;5(1):47-58.
[5] Salva MZ, Himeda CL, Tai PW, et al. Design of tissue-specific regulatory cassettes for high-level rAAV-mediated expression in skeletal and cardiac muscle. Mol Ther. 2007;15(2):320-9.
[6] England SB, Nicholson LV, Johnson MA, et al. Very mild muscular dystrophy associated with the deletion of 46% of dystrophin. Nature. 1990;343(6254):180-2.
[7] Martin PT, Xu R, Rodino-Klapac LR, et al. Overexpression of Galgt2 in skeletal muscle prevents injury resulting from eccentric contractions in both mdx and wild-type mice. Am J Physiol Cell Physiol. 2009;296(3):C476-88.
[8] Thomas PJ, Xu R, Martin PT. B4GALNT2 (GALGT2) Gene therapy reduces skeletal muscle pathology in the FKRP P1448L Mouse model of Limb girdle muscular dystrophy 2I. Am J Pathol. 2016;186(9):2429-48.
[9] Amoasii L, Hildyard JCW, Li H, et al. Gene editing restores dystrophin expression in a canine model of Duchenne muscular dystrophy. Science. 2018 Aug 30.
查看更多