查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





美国时间2020 年 4 月 10 日,针对瑞德西韦的研究进展,吉利德科学董事长兼首席执行官Daniel O’Day发布了一封公开信。
“今天早些时候,《新英格兰医学杂志》(NEJM) 发表了一篇关于我们的在研药物瑞德西韦对少数重症新型冠状病毒肺炎患者的治疗结果分析。
这些患者是无法参加临床试验的危重患者,通过同情用药程序,他们接受了瑞德西韦的治疗。针对 53 名首批通过该程序接受治疗的患者中,结果显示,大多数患者在使用瑞德西韦后都获得了临床改善。
我们知道,单纯从研究角度来看,这些同情用药的数据存在局限性,然而,我们也知道这些数据对于获得了症状改善的患者来说有着非常大的意义。这 53 名患者的早期数据并非通过临床试验获得,且数据只覆盖了少数接受瑞德西韦治疗的危重患者。
瑞德西韦是一种在研药物,尚未在世界上任何国家获得批准,需要更广泛的努力以确定它是否是一种安全、有效的治疗方案,对此,我们还有很多工作要做。多项临床试验正在全球范围内展开,以期构建完整的认知,了解瑞德西韦在不同情况下的应用结果。这些研究涵盖了人口统计学中的不同患者群体以及各种症状类型:中度症状、需要氧气支持的重度症状,和需要接受医学通气的危重症状。这些患者全部在医院通过静脉给药接受瑞德西韦的治疗。
在针对瑞德西韦的研究中,问题不仅仅是它对新型冠状病毒肺炎是否安全且有效,还有它对哪些患者表现出活性,患者应该接受多长时间的治疗,以及在疾病的哪个阶段治疗收益最大。我们需要很多答案,这也是我们为什么需要多种类型的研究,涉及多种类型的患者的原因。
未来几周,我们将收到正在进行的各项临床试验的第一批数据,将逐渐获得其中的一些答案。”
瑞德西韦的临床试验
有七项临床试验已经启动,以确定瑞德西韦治疗新型冠状病毒肺炎的安全性和有效性。每一项试验的启动都体现了前所未有的速度,这要归功于参与试验各方的非凡努力,以及我们对瑞德西韦已有的认知水平。
在某种程度上,随着我们对疾病本身的理解不断发展,对这些试验的设计也需要进行相应的调整。病毒出现和传播的速度非常快,大家都在努力地去迅速了解它。我们对试验结果的解读也将随着我们对这种疾病的不断了解而调整。
这些试验的启动顺序反映出了这一流行病的发展轨迹。中国在二月初启动了最早的两项对重症和中症患者的研究。此后,新增的五项试验在世界各地启动。
吉利德正在美国、亚洲和欧洲的新型冠状病毒肺炎高发地区进行两项三期研究。其中一项研究针对重症患者,另一项研究针对中症患者。这些研究要回答的众多问题之一是治疗时间是否可以从 10 天缩短到 5 天。重症的入组患者人数已达到了最初设计要求的人数,我们现在已经扩大了研究范围,让包括接受机械通气的患者在内的更多患者可以参与其中。
美国国家过敏和传染病研究所(NIAID)于 2 月 21 日开始了一项全球试验。该试验将随机分配患者使用瑞德西韦或安慰剂,以对照比较试验结果。该试验正在入组约 800 名具有不同症状的患者。
世界卫生组织也在进行一项全球试验,名为Solidarity,Inserm DisCoVeRy 试验最近已在 洲开始。下图中可以看到瑞德西韦各项试验的汇总和预期的数据公布时间。
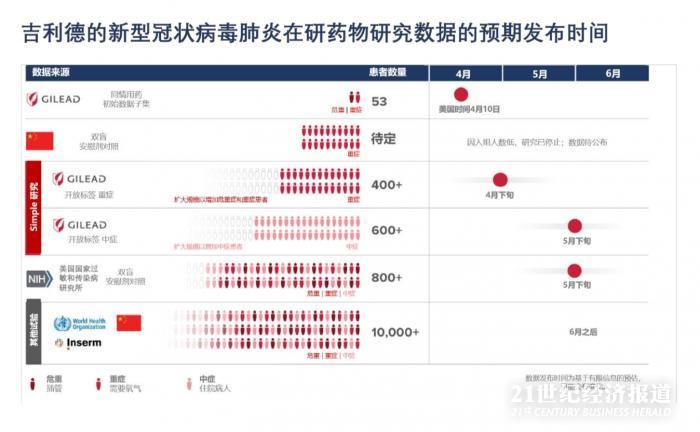
我们知道,大家高度关注我们什么时候能够获得这些试验的数据,以及这些数据将告诉我们关于瑞德西韦的什么信息。怀着紧迫感,我们在等待科学的解读。随着时间一天天过去,要为医护人员及他们的患者提供安全、有效的治疗方法的需求变得更加急迫。我们正在全速工作以确定瑞德西韦是否可以作为一种方案,我们承诺将及时与大家分享我们获得的信息。
我们预计在四月底获得瑞德西韦针对重症患者研究的初步数据,我们将迅速进行数据解读并分享结果。中国的研究者将负责发布瑞德西韦在中国的试验数据,但是,我们已获悉,因入组停滞,针对重症患者的研究已停止。我们期待在适当的时候看到公布的数据。我们预计五月份获得有安慰剂对照的 NIAID 试验的初步数据,以及吉利德的针对中度症状新型冠状病毒肺炎患者的研究数据。
在很大程度上,对于一种新出现的疾病,流行病学和对治疗方法的研究所面临的众多挑战会决定时间的进展。就如同这次疫情,对于参与其中的我们来说,这是一个未知的领域。
正在进行的合作
因为情况紧急,我们可能会感觉等待数据的时间很漫长,然而,现在距离首批临床试验开始仅有两个月。通常一个在研的治疗方案可能需要一年甚至更长时间获得首个临床数据,我们预计这么快拿到瑞德西韦的首个试验数据,这是非常了不起的。
这样的速度是大家通力合作的结果,离不开从监管机构到医院管理者、临床医生和研究人员等各参与方的巨大奉献。与所有关于瑞德西韦的工作一样,每个人都怀揣同样的紧迫感 和自始至终对科学严谨的承诺。
吉利德的全体员工对众多的团体和组织心怀感激,大家正在合作寻找关于瑞德西韦的答案,最重要的是,我们要尤其感谢参与临床试验的医生和患者。当我们讲述试验结时, 我们更倾向于从数字、趋势和统计学的角度来思考。我们知道,每一个数字的背后是一个 同意参加试验,并把他们经历试验的数据分享出来的患者。感谢他们,因为有了许多这样 的患者和他们的治疗医生,我们才能够确定,瑞德西韦是否能够安全且有效地在未来用于 更多的患者。
关于同情使用的使用结果
4 月 10 日,吉利德科学公司(纳斯达克代码:GILD)今天宣布了一项队列分析的结果,数据针对 53 名新型冠状病毒肺炎严重并发症的住院患者,他们以个例同情用药的方式,接受了在研抗病毒药物瑞德西韦的治疗。在这 53 名来自全球的患者中,大多数患者获得了临床改善,且没有提示新的关于瑞德西韦安全性的信号。同情用药的数据具有局限性,而多项正在进行中的三期临床研究将确定瑞德西韦治疗新型冠状病毒肺炎的安全性和有效 性。该分析的详细结果今天已在《新英格兰医学杂志》上发表。
瑞德西韦目前尚未在全球任何国家获得批准,对于治疗新型冠状病毒肺炎的安全性或有效性尚不明确。
该队列中近三分之二的患者(64%,n=34/53)在基线时需要机械通气,其中包括四名接受了体外肺膜氧合(ECMO)的患者。首次使用瑞德西韦后 18 天的中位随访期内,68%接受瑞德西韦治疗的患者(n=36/53)的氧气支持水平得到改善。超过一半的需要机械通气的患者可以拔管(57%, n=17/30),所有患者中近一半(47%,n=25/53)在接受瑞德西韦治疗后院。随访 28 天后,根据 Kaplan-Meier 分析,临床改善的累积发生率为84%,累积发生率定义为患者出院和/或在预先定义的 6 分等级量表上与基线相比至少有 2 分改善。相比使用无创通气的患者,使用有创通气的患 者的临床改善发生频率较低(HR:0.33 [95% CI 0.16,0.68]);70 岁及以上患者的临床改善发生 频率较低(HR vs<50 岁:0.29 [95% CI 0.11,0.74])。同情用药数据存在局限性,因为用药队列的规模小,随访时间相对较短,同情用药的性质本身可能导致数据丢失,且缺乏随机对照组。
“目前,针对新型冠状病毒肺炎尚无已经被证实的治疗方法。我们无法从这些数据中得出明确的结论,但是观察接受瑞德西韦治疗的这组住院患者,我们获得的结果是有希望的。”这篇文章的作者医学博士 Jonathan D. Grein,洛杉矶西达赛奈医疗中心流行病医院院长表示,“我们期待对照临床研究的结果,可以验证现有的发现。”
有创通气患者亚组的死亡率(18%,n=6/34) 相较无创通 氧支持患者的死亡率(5%,n=1/19)更高。与死亡风险增加相关的因素包括年龄大于 70 岁(HR vs <70 岁:11.34 [95% CI 1.36, 94.17])和代表肾功能下降的较高的基线血清肌酐水平(HR per mg / dL: 1.91 [95% CI 1.22, 2.99])。
在该队列中观察到轻度至中度肝酶(ALT 和/或 AST)升高(23%, n=12/53)。短期的瑞德西韦治疗期间未检测到新的安全性信号。
考虑到该数据和分析的局限性,我们仍需要正在进行中的瑞德西韦随机的临床研究数据,才能对瑞德西韦治疗的临床影响提供科学可靠的认识。
“尽管在同情用药分析中观察到的结果令人鼓舞,但数据有限,” 吉利德科学公司首席医疗官,医学博士 Merdad Parsey 说。 “吉利德目前正在开展瑞德西韦的多项临床研究,预计未来几周会有初步数据。我们的目标是尽快积累越来越多的证实数据,以更充分地评估瑞德西韦的潜力,并在恰当的情况下,支持该在研药物更广泛的应用。”
吉利德在新型冠状病毒肺炎高发的国家开展了两项瑞德西韦的三期临床研究,名为SIMPLE 研究。 我们预计,针对重症患者的 SIMPLE 研究数据将在本月获得,5 月将获得针对中度患者的 SIMPLE 研究数据。此外,吉利德还在支持由其他机构牵头的多项临床研究,其中包括两项在中国湖北省进行的研究。
吉利德获悉,由于入组人数低,在中国进行的针对重症患者的研究已提前终止。正在等待这些数据的发布,以便对结果进行深入评估。在中国,对轻至中度患者的研究还在进行中。由美国国家过敏和传染病研究所(NIAID)领导一项瑞德西韦的全球性研究仍在招募患者, 该研究的数据预计在 5 月公布。此外,基于世界卫生组织(WHO)的主研究方案,包括瑞德西韦在 内的新型冠状病毒肺炎在研疗法的更多研究,也已开始在世界各国进行患者入组。
关于同情用药队列分析
自 2020 年 1 月 25 日起,对于无法参加正在进行的临床研究,且符合条件的新型冠状病毒肺炎严重并发症的患者,吉利德提供了瑞德西韦用于紧急使用。以个例为基础,1800 多名患者已经通过同情用药方式,接受了瑞德西韦的治疗。
该队列评估了来自美国,欧洲,加拿大和日本的 53 名患者的数据,这些患者通过吉利德的同情用药项目,在 2020 年 3 月 7 日或之前接受了至少一剂瑞德西韦的治疗。 所有患者均因新型冠状病毒的感染入院,他们或者是血氧饱和度等于或低于 94%,或者需要氧气。开始使用瑞德西韦治疗前, 患者出现症状的中位时间为 12 天。大多数(75%)患者是年龄在 60 岁以上且患有高血压、糖尿病、 高血脂和哮喘等合并症的男性患者。这三个因素综合起来都与新型冠状病毒肺炎的不良后果相关。
对患者的治疗计划是一个使用瑞德西韦 10 天的疗程,包括第 1 天静脉给药 200 mg 初始剂量,然后在剩余的 9 个治疗日中每天 100 mg。此项分析中的 53 位患者中,有 75%接受了瑞德西韦 10 天 全程治疗,有 19%接受了 5-9 天的治疗,有 6%接受了少于 5 天的治疗。在瑞德西韦治疗开始后的 28 天持续随访。其中,4 名患者过早停用瑞德西韦,1 人因既往肾功能衰竭加重,1 人因多器官功 能衰竭,2 人肝酶升高,这两人中有 1 人出现斑状丘疹。
同情用药项目没有预先设定的终点。对其数据的分析中,对氧气支持要求的变化、患者出院、导致瑞德西韦治疗中断的不良事件报告、以及死亡率这些关键临床事件的发生率进行了量化。此外,分析评估了患者临床改善的比例,其定义为从患者出院,和/或对比基线在世界卫生组织研发蓝图小组(World Health Organization R&D Blueprint Group)推荐的反映住院和氧气支持状况6分等级 量表上,至少有 2 分改善。
来源:人民日报
查看更多