查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:浙江大学医学院附属邵逸夫医院 李风英 袁琴 郑芬萍 张钧
前 言
原发性醛固酮增多症(简称原醛症,PA)是由于肾上腺皮质发生病变从而分泌过多的醛固酮,导致水钠潴留、血容量增加、肾素-血管紧张素系统活性受抑制。临床主要表现为高血压、伴/不伴不同程度的低钾血症、肾素活性抑制(且不受容量和钠调节),其病因主要为醛固酮腺瘤(APA,占30%)和双侧肾上腺增生(特醛症IHA,占60%)。
原醛症是最常见的继发性高血压病因之一,占高血压人群中5%-10%,而在难治性高血压中占10%-20%。及早地发现、诊断、治疗原醛症可使部分原醛症通过手术治愈或选择MRAs针对性治疗,减少心脑血管疾病风险。
本案例为一青年男性患者,高血压病史10余年,合并低钾血症,肾上腺影像学提示双侧肾上腺多发结节,功能试验证实为“原发性醛固酮增多症”,经过双侧肾上腺静脉采血最终找到真凶,成功进行手术治疗。
案例经过
1、病例情况
患者男性,39岁,公司职员,主诉:血压高12年,发现肾上腺占位、低钾2年
现病史:患者12年前开始发现血压升高,具体数值不详,伴体重增加,腹部、颈部、躯干部脂肪增加为主,无阵发性心悸头痛大汗,无夜尿增加,8年前开始服用“氨氯地平5mg每日一次、厄贝沙坦氢氯噻嗪1片每日一次”降压治疗,血压控制可。
2年前因“肾结石”外院住院期间检查发现“左侧肾上腺腺瘤、低钾血症”,当时建议手术治疗,患者拒绝,调整为“厄贝沙坦150mg每日一次、氨氯地平5mg每日一次”降压,血压控制在140/90mmHg左右,2年来不规律复查血钾波动在“3~3.5mmol/L”,稍感乏力,间断口服补钾。
患者为进一步诊治来我院泌尿外科就诊,门诊收住入院,复查肾上腺增强CT提示“两侧肾上腺增粗伴多发结节,大者直径约18mm,增强后轻度强化,两侧肾上腺腺瘤考虑(图1)”,经会诊后转入内分泌科病房。
既往史:自幼隐睾,“双侧隐睾下降固定术后”25年余,青春发育正常,无生育能力。
查体:血压143/90mmHg,BMI26.8kg/m2,颈部脂肪垫。
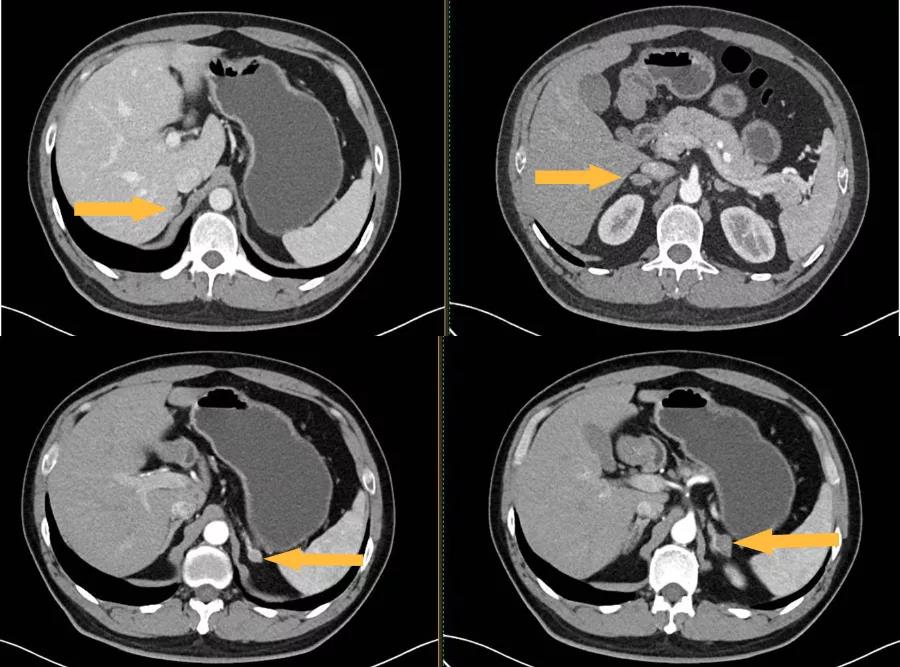
图1肾上腺增强CT提示双侧肾上腺多发结节,增强后轻度强化,腺瘤考虑
初步诊断:高血压、低钾血症、双侧肾上腺结节样增生待查
该病例特点为青年男性,慢性病程、无高血压家族史、隐睾手术史,青春发育正常,无生育能力、两联药物降压治疗,血压控制一般、无利尿剂使用情况下,反复低钾血症、肾上腺影像学提示双侧病变。
究竟是什么病因导致其血压难以控制,反复低血钾?
该案例诊断有三个关键点,
其一:患者青年男性,高血压、自发性低钾血症及双侧肾上腺结节样增生,需排查肾上腺性继发性高血压可能;
其二:隐睾与高血压是否可用一元论来解释?
其三:既往2年前发现“左侧肾上腺腺瘤”,而此次住院复查提示“双侧肾上腺增生伴多发结节”,双侧肾上腺占位,病变部位如何确定?为明确诊断,进行了相关的实验室检查。
2、实验室检查结果:
1)肾功能无殊;24小时尿钾31.19↑mmol,同步血钾3.19↓mmol/L;24小时尿可的松160.6μg/24h(58.0-403.0),24小时尿醛固酮7.7μg/24h(1.0-8.0) ;
2)性激素:促黄体生成素19.53↑IU/L(男1.24-8.62),促卵泡生成素58.01↑IU/L (男1.27-19.26),睾酮1.75μg/L(1.75-7.81);硫酸脱氢表雄酮956.0ng/mL(男200-5000),17α羟孕酮1.70nmol/L(0-30);
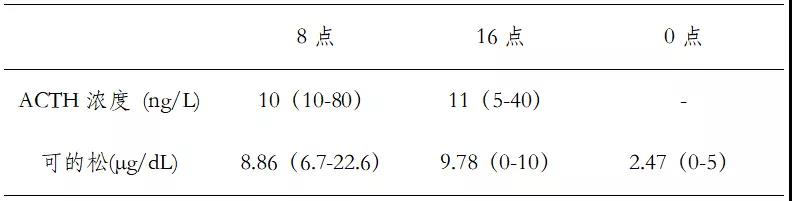
3)昼夜皮质醇节律紊乱(表1);
表1 昼夜皮质醇节律(静脉血)
4)小剂量地塞米松抑制试验:可的松(8am)1.54μg/dL(正常<1.8);
5)醛固酮立位筛查:醛固酮25.40ng/dL(3.0-35.3),肾素2.60↓μIU/mL(4.4-46.1),醛固酮/肾素比值(ARR)=9.77↑(正常<2.4);
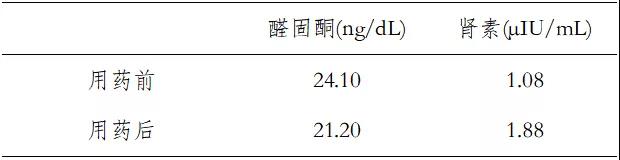
6)卡托普利试验:阳性(表2);
表2 卡托普利试验(静脉血)
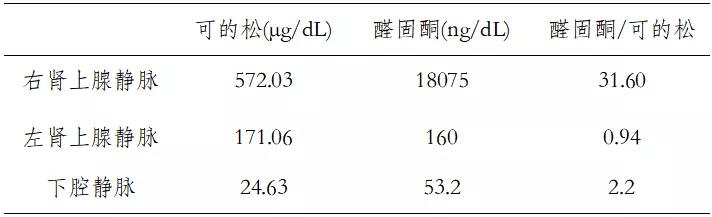
7)双侧肾上腺静脉采血(AVS):右侧肾上腺为优势侧(表3)。
表3 AVS
3、病例确诊过程
1) 肾上腺性高血压的鉴别诊断及排除
实验室结果显示,患者24h尿可的松正常,1mg地塞米松抑制试验被抑制,皮质醇节律稍紊乱,且无典型库欣体貌,排除库欣综合征;患者血压无明显波动,无典型临床症状,CT增强后强化不明显,增强较均匀,通过临床表现及影像学可基本排除嗜铬细胞瘤;
实验室检测ACTH未见升高,可的松、醛固酮未见降低,睾酮、硫酸脱氢表雄酮、17羟孕酮未见升高,排除11β羟化酶缺乏引起的先天性肾上腺皮质增生症;隐睾,性激素结果提示原发性性腺功能减退,无性分化异常,外生殖器正常,ACTH未见升高,硫酸脱氢表雄酮、17羟孕酮未见降低,排除17α羟化酶缺乏引起的先天性肾上腺皮质增生症及去氧皮质酮瘤,且考虑隐睾与高血压并不相关。
2) 原醛的确诊
24小时尿钾31.19mmol/24h,同步血钾3.19mmol/l;血钾尿钾均降低,证实为低钾血症,且为肾性失钾。
醛固酮立位筛查:醛固酮25.40ng/dl,肾素2.60μIU/ml,醛固酮/肾素比值(ARR)=9.77,以原醛初筛试验目前国内公认的ARR切点4.3判断,原发性醛固酮初筛试验阳性。
卡托普利抑制试验:醛固酮浓度由24.10ng/dL下降到21.20ng/dL,下降12%,未达到30%,醛固酮未被抑制,肾素未被激发,抑制试验阳性,可确诊为原发性醛固酮增多症。
3) 原醛的分型
原醛定性诊断确立后应进行分型诊断,以确定患者系单侧或双侧病变,从而进行精准治疗。双侧肾上腺静脉采血(AVS),比较左右两侧肾上腺静脉校正后醛固酮(醛固酮/可的松)差异,右/左=33.6>4,提示右侧优势分泌,病因考虑为右侧肾上腺醛固酮瘤。
结合病史、临床特点、辅助检查,该患者明确诊断为:原醛症,病因为右侧肾上腺醛固酮瘤。
4、治疗与随访
治疗方案:螺内酯40mg每日三次口服术前准备1周,行“后腹腔镜右肾上腺及肿物切除术”。
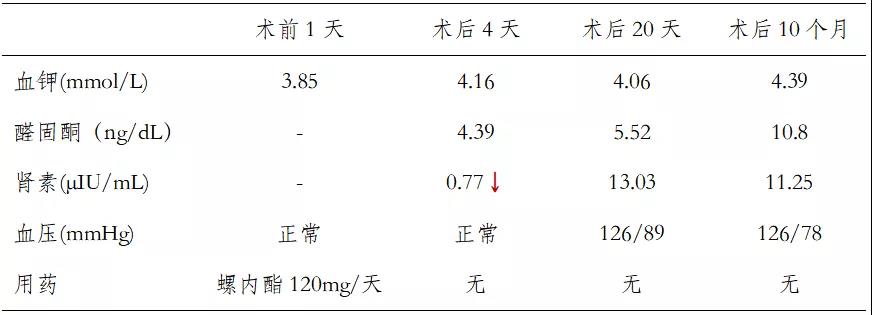
术后随访:术后4天该患者血压血钾及醛固酮水平均恢复正常,术后20天肾素抑制也被解除,术后10个月时不用任何降压药物情况下血钾、血压、醛固酮及肾素水平均正常(表4),复查肾上腺增强CT发现左侧肾上腺与术前相比,无明显变化。
表4 术后随访情况
临床案例分析
肾上腺性高血压是由于肾上腺皮质或髓质激素异常,特征表现为高血压、低钾血症以及肾上腺影像学异常,需要鉴别以下疾病:
(1)嗜铬细胞瘤及副神经节瘤:特征表现为阵发性心悸、头痛、大汗,85%-90%病灶位于肾上腺内,平扫CT值大于20Hu,富血供,对比剂廓清延迟,可伴出血或囊性改变,血尿儿茶酚胺水平升高;
(2)原醛症:肾上腺自主合成过多醛固酮,表现为轻中度血压升高、低钾血症、肾性失钾,醛固酮高,肾素低,醛固酮/肾素比值可作为筛查试验;
(3)库欣综合征:表现为体重增加,向心性肥胖,多血质面容、颈部及锁骨上脂肪垫,皮肤紫纹,皮肤菲薄等,皮质醇节律紊乱,小剂量地塞米松抑制试验不能被抑制;
(4)先天性肾上腺皮质增生症:其中11β羟化酶缺陷和17α羟化酶缺陷会导致盐皮质激素前体去氧皮质酮增加,表现为高血压、低钾血症;11β羟化酶缺陷导致去氧皮质酮和11去氧皮质酮不能转化成皮质酮和皮质醇,醛固酮、可的松减少,17羟孕酮、性激素合成增加,可表现为女性男性化及男性性早熟;17α羟化酶缺陷导致孕烯醇酮和孕酮无法转化为17羟孕烯醇酮和17羟孕酮,17羟孕酮、可的松、性激素合成减少,可表现为女性原发性闭经及男性假两性畸形;
(5)去氧皮质酮瘤:大部分肿瘤形态较大,呈恶性,自主分泌去氧皮质酮,典型表现为高血压、低血钾,低醛固酮、低肾素,去氧皮质酮与醛固酮结构类似,目前检测方法很难区分,但去氧皮质酮瘤还可分泌雄激素及雌激素,临床表现为女性男性化及男性女性化,可协助鉴别;
(6)Liddle综合征:也称假性醛固酮增多症,为肾小管上皮钠通道基因突变,钠重吸收增加,排钾增加,导致高血压、低血钾,同时低肾素、低醛固酮。
该病例需排查肾上腺性继发性高血压可能,患者临床表现及影像学可基本排除嗜铬细胞瘤,地塞米松抑制试验排除库欣综合征。
库欣综合征、原醛症、嗜铬细胞瘤为单一的皮质激素或髓质激素自主合成增加,不会伴随性激素合成减少,因此不会出现隐睾;而先天性肾上腺皮质增生症中的17α羟化酶缺陷因性激素合成障碍,在男性当中可伴隐睾,该患者无性分化异常,进一步评估皮质激素合成过程中各项激素水平,均无异常,排除高血压与隐睾一元论。
醛固酮/肾素比值筛查试验结果显示原醛症初筛阳性。患者双侧肾上腺占位,病变部位如何确定,需要结合相关检查抓到隐藏的“真凶”,才能进行下一步手术治疗。
检验案例分析
醛固酮、肾素检测对于原醛症的筛查和诊断具有重要价值。较为传统的检测方法为放射免疫分析法(RIA),通过测定血浆醛固酮与血浆肾素活性计算ARR,但该方法难于自动化、检测结果受血管紧张素原浓度、样品预处理、培养时间、pH酸碱度或其他因素的影响且对环境存在污染,将逐步被其他方法所取代。
目前越来越被广泛应用的化学发光免疫分析方法(CLIA),检测简便快速、稳定性重复性好,易于标准化。液相色谱串联质谱(LC-MS/MS)技术相较于化学发光发,可避免免疫交叉反应,具有更高的灵敏度、特异性及重复性,被认为是醛固酮检测的“金标准”,但由于仪器昂贵、耗材成本高、专业操作人员缺乏、实验室自建检测方法建立有待规范等原因,在临床的推广仍存在一定局限性。
本中心现采用化学发光免疫检测技术检测血浆醛固酮及活性肾素的浓度,通过ARR值对原醛进行了有效的筛查。同时该检验项目也是原醛分型必不可少的辅助手段。
本案例中由于该患者肾上腺为双侧病变,为评估有无优势侧,进一步行AVS。血浆醛固酮的检测范围为3-100ng/dL,对于肾上腺静脉大于>100ng/dL的血标本,视情况进行1:10、1:50、1:250、1:500稀释,确定数值。该案例中比较左右两侧肾上腺静脉校正后醛固酮(醛固酮/可的松)差异,提示右侧优势分泌,病因考虑为右侧肾上腺醛固酮瘤,从而抓到隐藏的“真凶”,明确了后续手术治疗的方案,并根治了高血压。
知识拓展
原醛症在高血压人群中比例为5%~10%,是最常见的继发性高血压,发病高峰在30-50岁,诊断过程分为筛查、确诊和分型三个步骤,该例患者有高血压,合并自发性低钾血症、双侧肾上腺占位,符合原醛症的筛查条件。
血浆醛固酮与肾素比值(ARR)是首选筛查指标,ARR的结果会直接影响后续临床诊断,可能导致结果假阴性的因素包括:低血钾、药物(利尿剂、ACEI、ARB、二氢吡啶类CCB)、低钠饮食等,可能导致结果假阳性的因素包括:高血钾、药物(β受体阻滞剂、中枢α2受体阻滞剂、非甾体抗炎药)、高钠饮食、年龄增长等;因此在筛查前需维持正常钠饮食,纠正低钾,停用醛固酮受体拮抗剂、利尿剂、甘草类药物至少4周,停用ACEI、ARB、二氢吡啶类CCB至少2周,保证ARR结果的准确性。
推荐筛查试验阳性的患者进行≥1项确诊试验,目前国内主要开展生理盐水抑制试验(SIT)或卡托普利试验(CCT),两者均具有较高的诊断效能,SIT短时间内输注大量生理盐水,可能导致心衰肾衰、血压急剧升高或严重低钾血症,因此在高龄、心肾功能不全患者中为禁忌;
卡托普利试验安全性更高,且操作方便,在门诊或病房均可进行,美国指南使用醛固酮抑制率≥30%作为诊断切点,国内有研究以服药后醛固酮11ng/dl作为切点值,诊断敏感性和特异性均为90%;另一项回顾性研究提出CCT服药后ARR最佳切点为46.2(ng∙dL-1)/(ng∙mL-1∙h-1),敏感性和特异性分别为88.7%和84.8%。
对于所有确诊原醛症(除外年龄<35岁,自发低钾,肾上腺单侧腺瘤;手术高风险,不考虑手术治疗;怀疑皮质癌;基因检测证实为家族性醛固酮增多症Ⅰ型或Ⅲ型患者),有手术意愿,肾上腺影像学提示单侧或双侧形态异常(增生或腺瘤),建议进一步行AVS明确有无优势分泌,AVS是原醛症分型诊断的“金标准”,本中心采用ACTH持续静滴下双侧同步采血,以选择指数(肾上腺静脉可的松/下腔静脉可的松)>3作为插管成功标志。
由于左肾上腺静脉有左膈下静脉汇入,会造成醛固酮和可的松浓度的稀释,因此在进行两侧醛固酮比较时,使用同侧可的松来校正误差,侧别指数是指两侧校正后醛固酮(醛固酮/可的松)的比值,>4则提示高的一侧为优势侧。近年来,越来越多的研究将非优势侧抑制指数(非优势侧校正后醛固酮/下腔静脉校正后醛固酮)作为参考指标之一,<1提示对侧优势。
案例总结
本案例是一名患病10余年之久的年轻高血压患者,因发现低钾血症和双侧肾上腺占位就诊,准确的定性是诊断的第一步,分型诊断则是制定治疗方案的关键,“眼见不一定为实”,影像学在原醛症分型诊断上存在一定局限性,像该例患者,双侧病变不一定就是“特醛症(双侧增生)”,利用更精准的技术(AVS),准确定位并进行肾上腺静脉局部激素检测帮助我们最终确定隐藏在双侧肾上腺中的真凶!
专家点评
(点评专家:郑芬萍,主任医师,浙江大学医学院附属邵逸夫医院内分泌科)
对于原醛症的诊治,由于其与原发性高血压临床特征极其相近,强调筛查的重要性。本例患者符合指南要求的筛查对象:年轻高血压(27岁诊断高血压)伴自发性低钾血症及高血压伴肾上腺占位。
利用醛固酮/肾素比值ARR筛查试验我们发现醛固酮25.40ng/dL,肾素2.60μIU/mL,ARR=9.77↑(正常<2.4),血浆肾素浓度(PRC)低于正常低限,而血清醛固酮水平(PAC)>15ng/dL,提示筛查试验阳性,且ARR比值>4.5即使无确诊试验,PA的定性诊断亦明确(当然,此例患者其后的卡托普利确诊试验亦支持PA定性诊断)。
准确地测定肾素和醛固酮水平是诊断PA的基础。现行的化学发光法直接测定有活性的肾素浓度(DRC)和PAC敏感性和特异性均>90%,且成本低,避免了放射性。基于PA的高发病率及极高的漏诊率,有学者建议对所有高血压患者一生中至少筛查一次ARR。
原醛定性诊断确立后应进行分型诊断,以确定患者系单侧或双侧病变。指南提出,对于原醛症定性诊断明确者,如肾上腺CT显示为正常或双侧病变、单侧增生或腺瘤且有手术意愿以长期获得PA缓解的患者需行AVS确定醛固酮分泌优势侧。
研究显示,CT对于分型诊断的准确性仅为50-60%,AVS系PA诊断的金标准。本例患者肾上腺CT增强提示双侧结节样增生伴腺瘤,且左侧腺瘤最大者直径近2cm。经AVS检测确定为右侧为醛固酮分泌优势侧,经右侧肾上腺切除术后患者获得了临床治愈(高血压停用所有药物,不补钾血钾正常,肾素抑制恢复、醛固酮水平不高)也证实了分型诊断的正确性。如该例患者未进行AVS检测,基本会被认定为系IHA,即使手术也一般切除影像学更明显一侧(即左侧),则后果不言而喻。
研究表明,以CT(显示单侧病变)或AVS分型诊断明确优势侧行单侧肾上腺切除术,后者可获得更高术后生化治愈率(即肾素和醛固酮水平恢复正常),也强调了AVS在有手术意愿的PA患者分型诊断中的重要性。而AVS的开展有赖于能够精确地测定醛固酮水平和操作医生的经验的累积。
目前国内外指南对于PA单侧优势病变者均统一建议行单侧肾上腺切除(而不是腺瘤摘除术)。近年来对于原醛症组织病理以及遗传学研究取得了极大的进展,增生的肾上腺、肾上腺微结节甚至在APA周围均发现有APCC(分泌醛固酮的细胞簇),组织病理研究的进展也为PA的术式提供了理论依据。本例患者的临床治愈也得益于完整的醛固酮分泌优势侧的单侧肾上腺完整切除。
鉴于原醛症的常见性、危害性及可治愈性(或针对性的治疗),选择该例患者进行系统的原醛症诊断和治疗的阐述以提高临床医生对原醛症的认识和规范诊疗能力,以减少PA的漏诊和错治。
来源:检验医学
查看更多